
4、计算技巧
(1)差量法
[例]在一个固定体积的密闭容器中,放入2molX和3molY,在一定条件下反应:4X(气)+3Y(气) 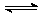 2Q(气)+nR(气)达到平衡后,容器内温度不变,容器内压强比原来增加5%,X的浓度减小1/3,则反应方程中的n值为( C ) A、5 B、3 C、6
D、2
2Q(气)+nR(气)达到平衡后,容器内温度不变,容器内压强比原来增加5%,X的浓度减小1/3,则反应方程中的n值为( C ) A、5 B、3 C、6
D、2
解析:由题意可知反应向右进行,并且气体物质的量增大,则右边气体系数大,故2+n>4+3,n>5,大于5的只有6,故选C
(2)极限法
[例]在一定温度下的密闭容器中加入CO和H2O(气)各1mol当反应
CO+H2O(气)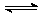 CO2+H2 达到平衡时生成0.5mol的CO2,若其它条件不变,再充入8molH2O(气)重新达到平衡时CO2的物质的量为
( B )
CO2+H2 达到平衡时生成0.5mol的CO2,若其它条件不变,再充入8molH2O(气)重新达到平衡时CO2的物质的量为
( B )
A、0.5mol B、0.93mol C、1mol D、1.5mol
解析:增加H2O的量,平衡右移,CO2必定增多,CO的转化率必定增大,之于增多大,无法判断,故CO的总转化量范围是0.5<CO<1,
故CO2范围是0.5<CO2<1,在其范围的都符合,故选B
(3)守恒法
[例]将1molA、2molB的混合物132g在密闭容器中反应:
A(气)+2B(气)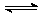 2C(气)+2D(气)达到平衡后,测得A的转化率为30%,则平衡时混合气体的平均分子量为( C )
2C(气)+2D(气)达到平衡后,测得A的转化率为30%,则平衡时混合气体的平均分子量为( C )
A、44 B、48 C、40 D、52
解析:因为反应前后均为气体,故气体质量始终不变,又因为反应向右进行,故气体物质的量必定增多,摩尔质量必定减小,不转化时平均摩尔质量是44,故应小于44,所以选C
3、反应物转化率与浓度的关系
⑴对于多种物质参加的反应(气、液态)
m A (g) +n B (g) 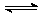 p C (g) +q D (g)
p C (g) +q D (g)
反应达到平衡后,C( A )↑ ,B的转化率可提高,但A的转化率一般降低; C (B) ↑ ,A的转化率可提高,但B 的转化率一般降低。
m +n > p +q :恒容同时按原比例增加A、B的量,A、B的转化率都增大。
恒压同时按原比例增加A、B的量,A、B的转化率不变
m +n< p +q :恒容同时按原比例增加A、B的量,A、B的转化率都减小。
恒压同时按原比例增加A、B的量,A、B的转化率不变
m +n= p +q :不论恒容还是恒压,同时按原比例增加A、B的量,A、B的转化率都不变。
⑵对于分解反应,要视反应前后物质的化学计量数而定
m A(g) 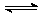 n B(g) + p C(g)
n B(g) + p C(g)
m = n + p:不论如何改变反应物的浓度,反应物的转化率都不变。
m < n +p:增加反应物的浓度时,反应物的转化率减小。
m > n+ p:增加反应物的浓度时,反应物的转化率增大。
对于两端都只有一种物质的反应,恒容条件下,不管加那端的物质,百分含量和转化率都用加压平衡向气体系数小的方向移动去分析。
例:2NO2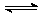 N2O4反应达到平衡后,不管加谁,若恒温恒容反应,达新平衡后,NO2百分含量减小,N2O4百分含量增大。
N2O4反应达到平衡后,不管加谁,若恒温恒容反应,达新平衡后,NO2百分含量减小,N2O4百分含量增大。
2.可逆反应进行程度的描述方法:转化率、产率
(1)反应物的转化率=反应物的转化量/该反应物起始量×100%
(2)产物的产率=产物的实际量/该产物的理论量×100%
3.对于反应物:平 = 始-转 对于生成物:平 = 始 + 转
例:反应CO+H2O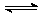 H2+CO2在773K时平衡常数K=9,如反应开始时C(H2O)=C(CO)=0.020mol·L-1求CO的转化率。
H2+CO2在773K时平衡常数K=9,如反应开始时C(H2O)=C(CO)=0.020mol·L-1求CO的转化率。
解:
CO + H2O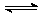 H2
+ CO2
H2
+ CO2
初始(mol·L-1) 0.02 0.02 0 0
变化(mol·L-1) x x x x
平衡(mol·L-1) 0.02-x 0.02-x x x
K=[x/(0.02-x)]2=9 x/(0.02-x)=3
解得 x=0.015mol·L-1
转化率=(0.015/0.020)×100%=75%
2.这里a、b可指 物质的量、浓度、体积等
1.化学平衡计算的基本模式-平衡“三步曲”(三段式)
注意:1.转化量与方程式中各物质的系数成比例
(三)、恒温恒容,左右气体系数不相等
典例精析1、某温度下,向某密闭容器中加入1 mol N2和3 mol H2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m。假设N2、H2、NH3的加入量(单位:mol)用x、y、z表示,应满足:
(1)恒定温度、体积
①若x = 0,y = 0,则z =_________;
②若x = 0.75,y = _________,则z =_________;
③x、y、z应满足的一般条件是_______________________________。
(2)恒定温度、压强
①若x = 0,y = 0,则z =_________;
②若x = 0.75,y = _________,则z =_________;
③x、y、z应满足的一般条件是_______________________________。
解析:本题属于等效平衡类型的常见题型,常利用极值转化法;
N2(g) + 3 H2(g) 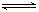 2 NH3(g)
2 NH3(g)
化学计量数: 1 3 2
状态 0 0 z z=2
状态‚ 0.75 y z
转化后: 0.75+z/2 y+3z/2 0
0.75+z/2 =1 z =0.5
 y+3z/2 =3
y= 0.75
y+3z/2 =3
y= 0.75
ƒ、由于恒温恒容下,该反应为系数变化的反应,需推一端量相等:
故有: x+z/2=1 y+3z/2=3
(2)在恒温恒压时,为等比:
z可取任意值
‚同(1)中‚同
ƒ恒温恒压,故有: (x+z/2)/(y+3z/2)=1/3
练习1、在容积相同的A.B两个密闭容器中,分别充入2molSO2和1molO2,使它们在相同的温度下发生反应:2SO2+O2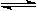 2SO3,并达到平衡。在反应过程中,若A容器保持体积不变,B容器保持压强不变,当A中的SO2的转化率为25%时,则B容器中SO2的转化率应是( ) ( )
2SO3,并达到平衡。在反应过程中,若A容器保持体积不变,B容器保持压强不变,当A中的SO2的转化率为25%时,则B容器中SO2的转化率应是( ) ( )
A.25% B.>25% C.<25% D.12.5%
练习2、将2 mol SO2和2 mol SO3气体,充入固定体积的密闭容器,在一定条件下发生下列反应:2SO2+O2 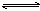 2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是( )
2SO3,平衡时SO3为n mol,相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,到达平衡时SO3的物质的量大于n mol的是( )
A.2 mol SO2+1mol O2 B.4 mol SO2+1mol O2
C.2 mol SO2+1mol O2 +2 mol SO3 D.3 mol SO2+1 mol SO3
练习3、某温度下, 在固定体积的密闭容器中, 可逆反应 A(气) + 3B(气) 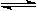 2C(气) 达到平衡时, 各物质的物质的量之比为A:B:C = 2:2:1,保持温度不变,以2:2:1的物质的量之比再次充入A.B.C,则 ( )
2C(气) 达到平衡时, 各物质的物质的量之比为A:B:C = 2:2:1,保持温度不变,以2:2:1的物质的量之比再次充入A.B.C,则 ( )
A.平衡正向移动 B.平衡不移动
C.平衡时C的体积分数增大 D.平衡时C的体积分数可能变小
练习4、在500K,相同体积的甲、乙容器,甲容器中充入m g SO2和m g O2,乙容器中充入n g SO2和n g O2 (n>m),则下列叙述错误的是: ( )
A.化学反应速率:乙>甲 B.平衡时O2的浓度:乙>甲
C.SO2的转化率:甲>乙 D.平衡时SO2的体积分数:甲<乙
练习5、在一固定容积的密闭容器中充入1molNO2,一定温度下建立如下平衡:2NO2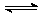 N2O4
,此时NO2的转化率为x%,若再充入1molNO2,在温度不变的情况下,达到新的平衡时,测得NO2的转化率为y%,则x、y的大小关系正确的是( )
N2O4
,此时NO2的转化率为x%,若再充入1molNO2,在温度不变的情况下,达到新的平衡时,测得NO2的转化率为y%,则x、y的大小关系正确的是( )
A. x>y B. x<y C.x=y D.不能确定
综合练习1、有一可逆反应: ,若按下列两种配比在同温同体积的密闭容器中进行反应:
,若按下列两种配比在同温同体积的密闭容器中进行反应:
(1)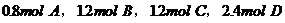
(2)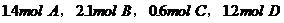
达到平衡后,C的质量分数相等,则方程式中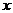 值为( )
值为( )
A. 1 B. 2 C. 3 D. 4
综合练习2、在一恒定的容器中充入2molA和1molB发生反应:2A(g)+B(g)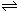 xC(g),到平衡后,C的体积分数为W%:若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol,C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则比值为:( )
xC(g),到平衡后,C的体积分数为W%:若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol,C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则比值为:( )
A.只能为2 B.只能为3 C.可能是2,也可能是3 D.无法确定
综合练习3、体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2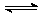 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率:( )
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率:( )
A.等于p% B.大于p% C.小于p% D.无法判断
化学平衡计算专题突破
(二)、恒温恒容,左右气体系数相等
例1、在一个固定容积的密闭容器中,保持一定温度进行以下反应:
H2(g) + Br2(g) 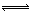 2HBr(g) ,已知加入1 mol H2 和2molBr2,达到平衡时生成amol HBr。在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号①-③的状态,填写表中的空白:
2HBr(g) ,已知加入1 mol H2 和2molBr2,达到平衡时生成amol HBr。在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号①-③的状态,填写表中的空白:
 已知 已知编号 |
起始状态物质的量(mol) |
平衡时HBr物质的量 |
||
|
H2 |
Br2 |
HBr |
||
|
1 |
2 |
0 |
a |
|
|
① |
2 |
4 |
0 |
2 a |
|
② |
0 |
0.5 |
1 |
0.5 a |
|
③ |
m |
g(g≥m) |
2g-4m |
(g-m)a |
解析:计算方法同恒温恒压下的例一,起始量是几倍,则转化量是几倍,平衡量就是几倍,根据比例计算。
③中因g≥m,故HBr可以有或没有,可设其物质的量为x,令其完全转化,则H2物质的量为(m+0.5x)mol,Br2物质的量为(g +0.5x)mol,
又因n(H2) :n(Br2)=1:2,故(m+0.5x):(g +0.5x)=1:2,
解得x=2(g-2m) mol,即n(HBr)= 2(g-2m) mol,令HBr完全转化,H2总的物质的量为(g-m)mol其量是原H2的(g-m)倍,则其平衡量也为(g-m)倍,即(g-m)a mol。
练习1、在等温、等容条件下,有下列反应:2A(g)+2B(g) 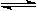 C(g)+3D(g)现分别从两条途径建立平衡:I:A.B的起始浓度均为2mol/L; II: C.D的起始浓度分别为2mol/L和6mol/L 。下列叙述正确的是( )
C(g)+3D(g)现分别从两条途径建立平衡:I:A.B的起始浓度均为2mol/L; II: C.D的起始浓度分别为2mol/L和6mol/L 。下列叙述正确的是( )
A.I、II 两途径最终达到平衡时,体系内混合气的百分组成相同
B.I、II两途径最终达到平衡时,体系内混合气的百分组成不相同
C.达到平衡后,I途径混合气体密度与II途径混合气体密度相同
D.达到平衡时,I途径的VA=II途径的VA
练习2、某温度下,1molCO和1molH2O(气)在2L的密闭容器中发生:CO+H2O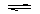 CO2+H2的反应达到平衡,若在同样容器和温度下,起始时将1molCO2和1molH2投入,平衡时得到相同的各组分浓度,则下列各种起始投料量能得到相同平衡状态的是(单位:mol) ( ) A.CO:1
H2O: 2
B.CO:0.5 H2O:0.5
CO2:0.5 H2:0.5
CO2+H2的反应达到平衡,若在同样容器和温度下,起始时将1molCO2和1molH2投入,平衡时得到相同的各组分浓度,则下列各种起始投料量能得到相同平衡状态的是(单位:mol) ( ) A.CO:1
H2O: 2
B.CO:0.5 H2O:0.5
CO2:0.5 H2:0.5
C.CO:0.8 H2O:0.8 CO2:0.2 H2:0.2
D.CO:0.1 H2O:0.1 CO2:0.9 H2:0.9
练习3、在容积相同的两个密闭容器中A和B保持温度为423K,若同时向A、B中加入amol及bmol的HI气体,且a>b,待反应:
2HI(气)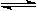 H2(气)+I2(气),达到平衡时,下列说法正确的是
A.从反应开始到达到平衡,所需时间tA>tB
H2(气)+I2(气),达到平衡时,下列说法正确的是
A.从反应开始到达到平衡,所需时间tA>tB
B.平衡时I2的浓度[I2]A=[I2]B
C.平衡时I2蒸气在混合气体中的体积分数A容器中的大于B容器
D.HI的分解率a A=a B
(一)恒温恒压
例1 、在一个盛有催化剂、容积可变的密闭容器中,保持一定温度和压强,进行以下反应:
N2(g)+3H2(g) 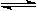 2NH3(g) 。已知加入1molN2和4molH2时,达到平衡后生成amolNH3,在相同温度、压强下,保持平衡时各组分的体积分数变。对下列编号①-③的状态,填写表中的空白。
2NH3(g) 。已知加入1molN2和4molH2时,达到平衡后生成amolNH3,在相同温度、压强下,保持平衡时各组分的体积分数变。对下列编号①-③的状态,填写表中的空白。
 已知 已知编号 |
起始状态物质的量(mol) |
平衡时NH3物质的量 |
||
|
N2 |
H2 |
NH3 |
||
|
1 |
4 |
0 |
a |
|
|
① |
1.5 |
6 |
0 |
1.5 a |
|
② |
0 |
0.5 |
1 |
0.5 a |
|
③ |
1 |
5 |
2 |
2 a |
解析:因转化率相同,故若都只加反应物,则起始量是几倍,则转化量是几倍,平衡量就是几倍,又因等压条件下物质的量之比等于体积之比,故起始量之比等于平衡量之比。①和题干量之比是1.5,平衡之比就是1.5。
②的平衡量是题干平衡量的一半,则若没有NH3,只有N2、H2,则其物质的量应分别为0.5和2mol,又因1 mol NH3完全转化生成N20.5 mol,H21.5mol,故原来的N2、H2分别为0 mol 和0.5mol。③可同理推得。
例2、恒温、恒压下,在一个可变容积的容器中发生如下发应:
A(g)+B(g)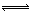 C(g)
C(g)
(1)若开始时放入1molA和1molB,到达平衡后,生成a molC,这时A的物质的量为 mol。
(2)若开始时放入3molA和3molB,到达平衡后,生成C的物质的量为
mol。
(3)若开始时放入x molA,2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3a mol,则x= mol,y= mol。平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是 。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是 。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1molA和1molB到达平衡后生成b molC。将b与(1)小题中的a进行比较 (选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小
作出此判断的理由是 。
答案:(1) 1-a(2) 3a(3) 2 3-3a D
a的范围为:0<a<1,但3-3a的范围只能确定在0-3之间,不能确定与2的关系。(4) a/(2-a)(5) 乙 由于该反应正反应为气体体积减小的反应,故(1)中为恒温恒压,相当于在II 中容器的基础上增加压强,此时平衡正向移动,故可得:a>b
解析:(1)
A( g) + B(g) 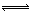 C(g)
C(g)
平衡前: 1 1 0
变 化: a a a
平衡后: 1-a 1-a a
(2)恒温恒压下,此平衡为等比:
故达平衡时,生成C应与(1)成比例,为3a mol
(3)极值转化法,
A( g) + B(g) 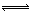 C(g)
C(g)
平衡前: x 2 1
变 化: 1 1 1
平衡后: x+1 y 3a
由平衡后C仍为3a mol,即与(2)中平衡状态相同,故有:
x+1=3 得:x = 2 mol
y = 3-3a
(4) 极值转化法:将3 mol C转化为A、B :
A( g) + B(g) 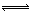 C(g)
C(g)
平衡前: 6 6 0
平衡后: 6-6a 6-a 6a
C的物质的量分数为: 6a÷[(6-6a)+(6-6a)+6a]=a/(2-a)
因百分含量不变,也可由(1)计算。
练习1、在一个活塞式的反应容器中,通入2molSO2和1molO2,于932K下发生化合反应并达到平衡,在保持恒温、恒压的条件下,再通入2molSO2和1molO2,下列叙述的内容完全正确的是( )
A.V正增大,V逆减小,平衡向正反应方向移动,SO3的百分含量增加
B.V正增大,V逆不变,平衡向正反应方向移动,SO3的百分含量增加
C.V正增大,V逆增大,平衡向正反应方向移动,SO3的百分含量增加
D.开始时V正增大,V逆减小,平衡向正反应方向移动;随后又逐渐恢复到原反应速率和原平衡状态,SO3的百分含量保持不变
练习2、在甲、乙两容器中各盛一定量的碳和二氧化碳(甲:12g碳,22g二氧化碳。乙:20g碳,22g二氧化碳),在同温同压下进行反应,达到平衡时,两容器中二氧化碳的转化率的关系为( ) A 甲大于乙 B 甲小于乙 C 甲等于乙 D 不能确定
3、等效平衡规律
mA(g)+nB(g)  pC(g)+qD(g)
pC(g)+qD(g)
|
条件 |
反应前后气体分子数关系 |
等效条件 |
结果 |
|
恒温恒容 |
不相等 m+n≠p+q |
极限转化后对应物质的物质的量相等 |
两次平衡时各组分百分含量、n、c均相同 |
|
相等 m+n=p+q |
极限转化后对应物质的物质的量比值相等 |
两次平衡时各组分百分量相同,n、c同比例变化 ,不一定相等 |
|
|
恒温恒压 |
不相等或相等 |
极限转化后对应物质的物质的量比值相等 |
两次平衡时各组分百分含量、c相同,n同比例变化 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com