
(四)、离子方程式正误判断
一看反应能否用离子方程式表示。
1、看离子反应是否符合客观事实,不可主观臆造产物及反应。如:铁和稀盐酸的反应:
2Fe+6H+=2Fe3++3H2↑
2、是离子反应,但不能写离子方程式。如: NH4Cl(s)+Ca(OH)2(s)→
Cu+H2SO4(浓) →
二看连接符号和状态符号是否准确。
1、 一般离子反应用“=”连接,可逆反应、弱电解质的电离、盐类水解反应用“ ”连接。
”连接。
2、 大多离子反应要用“↑”“↓”注明产物的状态,而盐类水解反应由于水解程度极弱,不能使用状态符号。
三看表示各物质的化学式是否准确。
1、强酸、强碱和易溶于水的盐要拆写为离子,难溶物质、难电离物质、挥发性物质、单质、氧化物、非电解质等要书写为化学式。
2、微溶物作为反应物,若是澄清溶液拆写为离子,若是悬浊液写为化学式。微溶物作为生成物,一般写为化学式,并标“↓”符号。
3、多元弱酸酸式根离子,在离子方程式中不能拆写。
四看是否漏写离子反应。如强硫酸与氢氧化钡的离子反应写为:Ba2++SO42-=BaSO4↓。
五看质量、电荷是否守恒,即离子方程式是否配平。离子方程式要做到两守恒:原子数目守恒,电荷数目守恒。如:Fe3++Cu=Fe2++Cu2+。
六看反应物或产物的配比是否正确,是否符合题设条件及要求。如“过量”、“少量”、“适量”、“足量”以及特殊的数值比等。
(三)、离子方程式书写的原则
1、强酸、强碱和易溶于水的盐改写成离子的形式,难溶物质、难电离物质、易挥发物质、单质、氧化物、非电解质等均写化学式。
2、微溶物作为反应物,若是澄清溶液拆写为离子,若是悬浊液写为化学式。微溶物作为生成物,一般写为化学式,并标“↓”符号。
3、固体与固体间的反应不能写离子方程式,浓H2SO4、浓H3PO4与固体的反应不能写离子方程式。
4、离子方程式要做到两守恒:原子数目守恒,电荷数目守恒。
5、多元弱酸的酸式酸根离子,在离子方程式中不能拆写。
6、一些特殊反应(如酸式盐与碱的反应、部分复杂的氧化还原反应)要考虑并满足反应物物质的量的比值。
(二)、离子共存问题
1、复分解型:在溶液中,若离子间能发生反应,如生成沉淀、弱电解质、气体等难电离的物质。(能使反应中离子浓度减小)
2、氧化还原反应型:Fe3+ 、MnO4-(H+)、NO3-(H+)、ClO-与S2-、HS-、SO32-、I-、S2O32-、Fe2+
NO3-只有在酸性条件下才有强氧化性; ClO- 在所有条件下都有强氧化性
3、强烈双水解反应:Al3+与AlO2-、S2-、HS-、SO32-、HCO3-、CO32-
Fe3+ 与HCO3-、CO32-等离子
4、络合类:Fe3+与SCN-( 色)、C6H5O-(H+)( 色) Cu2+、Ag+与NH3
注意隐含条件的限制,如①离子的颜色:无色溶液、蓝色溶液等
②、溶液的酸碱性:pH=3或13、pH试纸变红或变蓝、酚酞变红、甲基橙(石蕊)变红、溶液中c(H+)=1×10-14 mol·L-1或c(OH-)=1×10-14 mol·L-1
③、因发生氧化还原反应不能共存的
④、能与铝反应产生氢气的溶液可能是酸性(不能是硝酸),也可能是碱性;水电离出的H+(或OH-)的浓度是1×10-14 mol·L-1的溶液可能是酸性,也可能是碱性
⑤、先能共存,后加入盐酸或通入NH3有变化的
⑥、既能溶解Al(OH)3,又能溶解H2SiO3等
(一)、离子反应的类型
1、 溶液中进行的复分解反应 该类反应发生的条件为:1)生成 溶物质;2)生成 电离物质;3)生成 挥发性物质。 (填“难”或“易”)
2、溶液中进行的氧化还原反应: 对于自发的氧化还原反应,遵从 氧化性物质与 还原性物质反应生成 氧化性物质与 还原性物质。高温、电解条件另当别论。(填“强”或“弱”)
3、通过观察的化学现象及反应事实,揭示化学反应本质,把握反应的现象与本质以及离子之间消长的数量关系,使学生了解研究事物从个别到一般的思想方法,体验研究问题,寻找规律的方法。
2、离子共存问题覆盖面很广,涉及的知识点很多,试题会通过情景设计,考查学生学会分析、信息的提取与取舍,考查考生思维能力。
1、离子反应、离子反应方程式是历年高考的热点,在高考中重现率达标100%,要求考生掌握化学反应的实质,理解离子反应及离子方程式的意义;根据化学反应发生的条件对比不同条件下的离子反应区别和离子方程式的书写方法。
|
电解液 |
溶质类别 |
电解总反应式 |
相当于电解 |
溶液pH |
|
NaOH溶液 |
强碱 |
2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
水 |
升高 |
 H2SO4溶液 H2SO4溶液 |
含氧酸 |
降低 |
||
|
Na2SO4溶液 |
活泼金属的含氧酸盐 |
不 变 (两极混合液) |
||
|
CuCl2溶液 |
不活泼金属的无氧酸盐 |
CuCl2 Cu+Cl2↑ Cu+Cl2↑ |
电解质本身 |
接近7 |
|
HCl溶液 |
无氧酸 |
2HCl H2↑+Cl2↑ H2↑+Cl2↑ |
升高 |
|
|
NaCl溶液 |
活泼金属的无氧酸盐 |
2NaCl+2H2O H2+2NaOH+Cl2↑ H2+2NaOH+Cl2↑ |
电解质与水 |
升高 |
|
CuSO4溶液 |
不活泼金属的含氧酸盐 |
2CuSO4+2H2O 2Cu+O2↑+2H2SO4 2Cu+O2↑+2H2SO4 |
降低 |
|
|
NaCl(熔融) |
离子化合物 |
2NaCl 2Na+Cl2↑ 2Na+Cl2↑ |
电解质本身 |
|
|
Al2O3(熔融) |
2Al2O3 4Al+3O2↑ 4Al+3O2↑ |
思维技巧点拨
[例1] 镍氢电池是近年来开发出来的可充电电池,它可以取代会产生镉污染的镍镉电池。镍氢电池的总反应式是: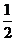 H2+NiO(OH)
H2+NiO(OH)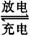 Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
Ni(OH)2。根据此反应式判断,下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,氢气是负极
 [解析] 本题考查在题目创设的新情景中运用所学电化学知识,解决具体问题的能力。首先是区别出充电运用的是电解原理,放电则是运用了原电池原理。抓住电解池、原电池各极发生氧化还原反应的特点,结合题给的信息进行分析判断:
[解析] 本题考查在题目创设的新情景中运用所学电化学知识,解决具体问题的能力。首先是区别出充电运用的是电解原理,放电则是运用了原电池原理。抓住电解池、原电池各极发生氧化还原反应的特点,结合题给的信息进行分析判断:
A:原电池负极反应式为: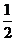 H2+OH-+e-
H2+OH-+e- Ni(OH)2,pH下降。故A不正确。
Ni(OH)2,pH下降。故A不正确。
B:原电池,NiO(OH)→Ni(OH)2,镍被还原。故B也不正确。同理可判断得:正确答案为CD。
[例2] 银器皿日久表面逐渐变黑色,这是由于生成硫化银,有人设计用原电池原理加以除去,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银不会损失。试回答:在此原电池反应中,负极发生的反应为________;正极发生的反应为_________;反应过程中产生有臭鸡蛋气味的气体,则原电池总反应方程式为___________________________。
[解析] 要善于抓住题示信息,“黑色褪去而银不会损失”,必然发生变化:Ag2S Ag,显然这是原电池的正极反应,Ag2S+2e-
Ag,显然这是原电池的正极反应,Ag2S+2e-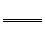 2Ag+S2-,负极反应为活泼金属发生氧化反应:Al-3e-
2Ag+S2-,负极反应为活泼金属发生氧化反应:Al-3e-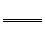 Al3+。正极生成的S2-和负极生成的Al3+在溶液中发生双水解:2Al3++3S2-+6H2O
Al3+。正极生成的S2-和负极生成的Al3+在溶液中发生双水解:2Al3++3S2-+6H2O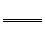 2Al(OH)3↓+3H2S↑,与题意产生臭鸡蛋气味的气体相吻合。原电池的总反应为上述三个反应的加合:3Ag2S+2Al+6H2O
2Al(OH)3↓+3H2S↑,与题意产生臭鸡蛋气味的气体相吻合。原电池的总反应为上述三个反应的加合:3Ag2S+2Al+6H2O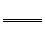 6Ag+2Al(OH)3↓+3H2S↑。
6Ag+2Al(OH)3↓+3H2S↑。
原电池:负极:M-ne-=Mn+
正极:(1)酸性溶液中2H++2e-=H2↑
(2)不活泼金属盐溶液Mn++ne-=M
(3)中性、弱酸性条件下2H2O+O2+4e-=4OH-
电解(镀)池:
阳极:(1)若阳极是由活性材料(除C、Pt、Au等以外的其它金属)做成,阳极反应是阳极金属失去电子而被氧化成阳离子;
(2)若阳极是由C、Pt、Au等惰性材料做成,阳极反应则是电解液中阴离子在阳极失去电子被氧化。阴离子失去电子能力大小顺序为:I->Br->Cl->OH->含氧酸根>F-。
阴极:阴极反应一般是溶液中的阳离子得电子的还原反应,阳离子得电子能力大小顺序为:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+。必须注意的是,电镀时通过控制条件,Fe2+和Zn2+得电子的能力强于H+。
2.确定电解(镀)池电极名称的方法
方法一:与外电源正极连接的一极是阳极、与负极连接的一极是阴极。
方法二:电极上发生氧化反应的是阳极,发生还原反应的是阴极。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com