
171.C在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应: H2(g)+I2(g) 2HI(g)
ΔH<0
2HI(g)
ΔH<0
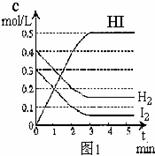
反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为 ;
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 ;
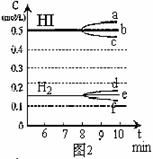
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K(填写增大、减小或不变) ,HI浓度的变化正确 ;(用图2中a-c的编号回答)
②若加入I2,H2浓度的变化正确的是 。(用图2中d-f的编号回答)
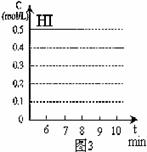
(4)反应达到平衡后,第8分钟时,若反应容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。
170.C在一个容积固定的反应器中,有一个可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入物质的量如下:A、B和C均为0.4mol,D为6.5mol,F为2.0mol。设E的物质的量为xmol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置。请填写以下空白:
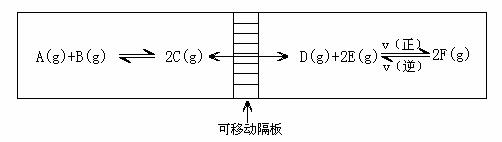
(1)若x=4.5,则右侧反应在起始时向 (填“正反应”或“逆反应”)方向进行,欲使起始反应维持向该方向进行,则x的最大值应小于 。
(2)若x分别为4.5和5.0,则在这两种情况下,当反应达到平衡时,A的物质的量 (填“相等”、“不相等”或“不能确定”),理由是 。
169.C恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g)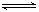 2NH3(g)
2NH3(g)
(1) 若反应进行到某时刻t时,n1(N2)=13 mol,n1(NH3)=6 mol,计算a的值。
(2) 反应达平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3) 原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同)。
n1(始)∶n1(平)= 。
(4) 原始混合气体中,a∶b= 。
(5) 达到平衡时,N2和H2的转化率之比,n1(N2)∶n1(H2)= 。
(6) 平衡混合气体中,n1(N2)∶n1(H2)∶n1(NH3)= 。
168.C某温度下,向某密闭容器中加入1 mol N2和3 mol H2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m。假设N2、H2、NH3的加入量(单位:mol)用x、y、z表示,应满足:
(1)恒定温度、体积
①若x = 0,y = 0,则z =_________;
②若x = 0.75,y = _________,则z =_________;
③x、y、z应满足的一般条件是_______________________________。
(2)恒定温度、压强
①若x = 0,y = 0,则z =_________;
②若x = 0.75,y = _________,则z =_________;
③x、y、z应满足的一般条件是_______________________________。
167. B在一定条件下,二氧化硫和氧气发生如下反应(10分):
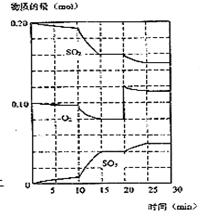 2SO2(g)+ O2 (g)
2SO2(g)+ O2 (g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)降低温度,该反应二氧化硫转化率 ,化学反应速 度 ,(以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反 应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(3)据图判断,反应进行至20min时,曲线发生变化的原因
(用文字表达)
10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
166.A在合成氨反应中,进入合成塔的气体体积比为N2∶H2∶NH3=6∶18∶1,从合成塔出来的气体体积比为N2∶H2∶NH3=9∶27∶8,则H2的转化率为_____________。
165.A二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45 s时,达到平衡(NO2浓度约为0.00125 mol·L-1)。图13-5中的曲线表示二氧化氮分解反应在前25 s内的反应进程。
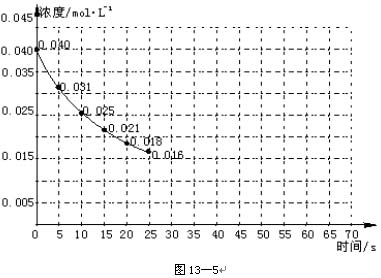
(1)请计算前20 s内氧气的平均生成速率。
(2)若反应延续至70s,请在图中用实线画出25s至70s的反应进程曲线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加催化剂后的反应进程曲线。
(4)写出该反应的化学平衡常数表达式:
164.A在一定温度下,在1 L容器中a mol SO2和b mol O2,反应达平衡时有c mol SO2发生了反应,试填写下列空白:
(1)生成___________mol SO3;
(2)O2的转化率为_____________;
(3)平衡时容器内气体总物质的量为____________mol;
(4)平衡体系中SO3的百分含量(体积比)为_____________;
(5)达到平衡时,c(SO2) = _______mol/L,c(O2) = _______mol/L,c(SO3) = ______mol/L。
163.A高炉炼铁中发生的基本反应之一如下:
FeO(固)+CO(气) Fe(固)+CO2(气)ΔH>0
Fe(固)+CO2(气)ΔH>0
(1)则该反应中平衡常数K= 。
(2)已知1100℃时K=0.263。温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 ,平衡常数K值 (均填增大,减小或不变)。
(3)1100℃时测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于平衡状态 (选填是或否),此时化学反应速率是
v正 v逆(选填>,<,=),其原因是
162.A下列过程吸热还是放热?体系的混乱度增大还是减小?
 (1) Fe(s)
Fe(g)
(1) Fe(s)
Fe(g)
 (2) H2(g)+
(2) H2(g)+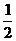 O2(g) H2O(l)
O2(g) H2O(l)
 (3) NaOH(s)
Na+(aq)+ OH-(aq)
(3) NaOH(s)
Na+(aq)+ OH-(aq)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com