
5.填入下面文字中横线上的句子,与上下文衔接最恰当的一项是(3分)( )
农村的道路像一些遗弃的绳子, ,永远不会有人想起来把它弄直;河流始终妄图躲开人类, ;树林是淡青的,它们已由自然繁殖生长改为人工种植, 。
①被随便地扔在田野上 ②把它随便地扔在田野上 ③村庄却总是在某个拐弯处踩住它 ④却总是在某个拐弯处被村庄踩住 ⑤这些本已归顺人类的植物不再能藏匿住任何一个童话了 ⑥任何一个童话也不能藏匿在这些本已归顺人类的植物中了 A.②④⑥ B.②③⑤ C.①③⑥ D.①④⑤
4.下列各句中,没有语病的一句是( )
A.从今天(17日)起至20日,我国黄淮及其以南地区将正出现今年以来最大范围强降雨过程,部分地区的过程雨量可超过100毫米。
B.对于新兴经济体来说,一方面要学习西方国家的经验、教训;另一方面要迈出改革创新的步伐,走一条真正适合自己的、可持续发展的道路。
C.根据2010年9月的才情数据显示来看,全国竞争最为激烈的十大行业中,计算机软件行业位居第一位,平均有76人竞争该行业同一职位。
D.随着入世和我国全方位对外开放新格局的形成,作为开放程度较高的城市,上海会受到世界经济的挑战,在文化领域也会受到一定的冲击。
3.下列各句中加点的成语使用不恰当的一句是( )
A.出于自身利益的考虑,一些地区画地为牢,实行地方保护主义,人为地分割和控制煤炭资源。
B.国务院纠风办在全国纠风工作会议上表示,监督检查决不能走马观花,搞形式主义,更不能劳民伤财。
C.一些网友认为,田亮虽然为我国的跳水事业做过贡献,但被冠以“民族英雄”的称号未免有些言过其实。
D.上天是公平的,只给每人一次机会,任你摆布,看你是否愿意珍惜喽!要记得一句话“机不可失,时不再来”!
2.下列词语中没有错别字的一项是( )
A.厮认 付屈衔冤 甬路 杳无音信
B. 抱负 抱怨 时辰 薪尽火传
C.署光 贤惠 生崖 无济于世
D.烦燥 藐视 赋与 名副其实
1、下列词语中加点字的注音正确的一项是( )
A.提防(tí) 纸鸢(yuān) 刽子手(kuài) 前合后偃(yǎn)
B. 羊肚汤(dù) 同胞(bāo) 毋须(wù) 折腾(zhē)
C. 汗涔涔(cén) 伺候(cì) 木讷(nè) 冗长(rǒng)
D.愠色(yùn) 潸然泪下(shān) 戏谑(nuè) 莅临(lì)
2.在 下,改变起始时加入物质的物质的量,只要按化学计量数换算成同一半边的物质的物质的量之比与原平衡相同,则达到平衡后与原平衡等效。
[例4](2007 四川13)
向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O (g)
 CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
A.0.5molCO+2molH2O(g)+1molCO2+1molH2
B.1molCO+1molH2O(g)+1molCO2+1molH2 .
C.0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D.0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2
[解析] 题中反应前后气体的体积不变,因此在恒温和恒容条件下是等效平衡的条件是CO和H2O (g)的物质的量之比与起始时加入的CO和H2O (g)的物质的量之比相等即可。因此只要将各个选项中的投料转化为CO和H2O (g)的物质的量,并与原平衡进行对比即可。
对于A选项中的配料相当于CO有1.5mol、H2O (g)有3mol,即二者之比为1︰2,所以此情况下的平衡与原平衡等效,即CO的体积分数仍为x;
对于B选项中的配料相当于CO有2mol、H2O (g)有2mol,相对于原平衡可以认为是在原平衡的基础上又加入了1molCO,相当于平衡向右移动,但是CO的体积分数增大,即大于x;
对于C选项中的配料相当于CO有0.9mol、H2O (g)有1.9mol,此投料相当于在0.9molCO和1.8molH2O (g)的平衡体系中再加入0.1molH2O (g),而0.9molCO和1.8molH2O (g)的平衡与原平衡是等效平衡,再加入0.1molH2O (g)时平衡向右移动,CO的体积分数减小,即小于x;
对于D选项中的配料相当于CO有1mol、H2O (g)有2mol,此平衡与平衡相同,所以CO的体积分数也为x。因此达到平衡时CO的体积分数大于x的只有B选项。
[答案]B
[规律总结]定温、定容时:①、对于一般的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。
②、对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量的比例与原平衡相同,两平衡等效。
考点5 化学平衡计算和化学平衡常数
(1)“起”、“转”、“平”三步骤计算的技巧(一般表示如下:)(例题见[真题1])
mA(g)+nB(g)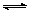 pC(g)+qD(g)
pC(g)+qD(g)
“起”始浓度: a b c d
“转”化浓度: mx nx px qx
“平”衡浓度: a-mx b-nx c+px d+qx
此三种浓度中,只有“转”化浓度之比等于计量数之比,常常要用平衡时候的数据求其他的值:
(1)如求A物质的平衡转化率α(A) α(A)=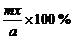
(2) 在恒温、等容的条件下,反应前后的压强比等于物质的量比。
(3) 求B物质平衡时的体积分数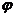 (B),
(B),
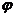 (B)=
(B)=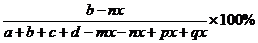
(2)化学平衡常数的计算和判断
一定温度下,对于可逆反应,mA(g)+nB(g)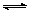 pC(g)+qDg) K=
pC(g)+qDg) K=
了解:●平衡常数K只与 有关;温度一定K一定
●平衡常数K的大小可以表示反应进行的程度;
●平衡常数K表达式中均为物质的量浓度,反应式不同K 。
[例5](08海南卷)X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.65%
[解析]由可知: X+2Y 2Z
2Z
起始: 1 1 0
转化: a 2a 2a
平衡: 1-a 1-2a 2a
根据题意有: = ,a=,Y的转化率最接近65%。
1.在定温(T)、定容(V)条件下的等效平衡
① 在定T、V条件下,对于反应前后气体分子数改变的可逆反应只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一半边的物质的物质的量 ,则两平衡等效。
②在定T、V条件下,对于反应前后气体分子数不改变的可逆反应只改变起始时加入物质的物质的量,只要反应物(或生成物)的物质的量的比值 ,则两平衡等效。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com