
3、强氧化性:
A:与金属的反应:完成下列方程式并改写成离子方程式:
Cu+ HNO3(浓)──
Cu+ HNO3(稀)──
思考与交流:(3)这两个反应的现象分别是什么?硝酸显示什么性质?
例题1:在如图所示的管中加入2g薄铜片和10mL6mol·L-1的稀硝酸,从反应开始,到反应结束,下列关于预期在试管中可观察到的现象的描述不正确的是( )
A.产生无色气体的速度开始缓慢,后逐渐加快
B.试管上部空间由无色变为浅红棕色,又变为无色
C.试管中溶液由无色变成蓝色
D.反应结束时,铜片全部反应完
规律总结:硝酸是一种强氧化性的酸,可以与几乎所有的金属反应产生硝酸盐( 除外,另外 常温下钝化),本身被还原成低价态的氮的化合物,无特殊说明浓硝酸还原产物产物是二氧化氮,稀硝酸的还原产物是一氧化氮。
思考与交流:(4)完成下列方程式:
Ag+ HNO3(稀)──
Ag+ HNO3(浓)───
Fe+ HNO3(稀,过量)───
B:与非金属的反应:
HNO3(浓) + C──
HNO3(浓)+ S──
规律总结:浓硝酸与非金属的反应与浓硫酸类似,产物是非金属的最高价氧化物或含氧酸,到底产生哪一种物质要看酸的稳定性。
C:与还原性物质反应,如 (经常用在离子共存问题中);
例题2:在浅绿色的Fe(NO3)2溶液中存在变化:Fe2++2H2O Fe(OH) 2+2H+,向其中加入盐酸后,溶液颜色的变化是( )
Fe(OH) 2+2H+,向其中加入盐酸后,溶液颜色的变化是( )
A.颜色变浅 B.逐渐加深 C.没有改变 D.变棕黄色
例题3:某溶夜可以与铝反应放出氢气,下列离子组一定可以共存的是( )
A.HCO3- Na+ ClO- NH4+ B.Ca2+ Al3+ Cl- Na+
C.Cl- NO3- Ba2+ Na+ D.K+ Na+ SO42- Cl-
2、不稳定性:见光或受热易分解
HNO3──
思考与交流:(2)硝酸该如何保存?
下列试剂需保存在棕色瓶中的是____
①FeSO4②AgNO3③氯水④AgBr⑤HNO3⑥NaHCO3
1、 强酸性:
A:与指示剂作用;
B:与盐的作用:
Na2CO3+HNO3──
C:与碱的作用与碱性氧化物作用等
HNO3+Ca(OH)2──
Fe2O3+HNO3──
(一)、硝酸的物理性质:
纯硝酸是 色、有 气味的 体,不纯硝酸是 色。浓硝酸是一种挥发性的酸,溶解性 于水。浓度为98%以上的浓硝酸在空气里产生“ ”现象。
思考与交流:(1)实验室里的浓硝酸常常呈现出黄色原因是什么?
2、(09上海卷 20)对于常温下pH为1的硝酸溶液,下列叙述正确的是
20)对于常温下pH为1的硝酸溶液,下列叙述正确的是
 A.该溶液lmL稀释至100mL后,pH等于3
A.该溶液lmL稀释至100mL后,pH等于3
 B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
 C.该溶液中硝酸电离出的
C.该溶液中硝酸电离出的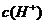 与水电离出的
与水电离出的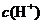 之比值为
之比值为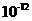 。
。
 D.该溶液中水电离出的
D.该溶液中水电离出的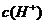 是pH为3的硝酸中水电离出的
是pH为3的硝酸中水电离出的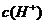 的100倍
的100倍
感悟高考:
1、(09全国卷Ⅱ6) 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是

 A. 1:4
B.1:5
C.
2:3
D.2:5
A. 1:4
B.1:5
C.
2:3
D.2:5
2、掌握HNO3的有关计算
1、掌握硝酸的物理性质和化学性质;
220.C在密闭容器中,由一定起始浓度的氙(Xe)和F2反应,可得到3种氟化物。各种生成物在平衡体系内的分压与反应温度的关系如右图所示(已知气体的分压之比等于物质的量之比。)
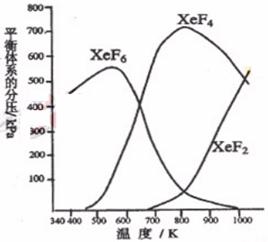
(1) 420K时,发生反应的化学方程式为: ;若反应中消耗1 mol Xe,则转移电子 mol。
(2) 600K-800K时,会发生反应:
XeF6(g) XeF4(g)+F2(g),
XeF4(g)+F2(g),
其反应热DH 0(填“>”、“=”或“<”)。理由是 。
(3) 900K时,容器中存在的组分有 。
219.B Fe3+和I-在水溶液中的反应如下:2I +2Fe
+2Fe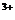
 2Fe
2Fe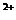 +I2(水溶液)。
+I2(水溶液)。
(1)该反应的平衡常数K的表达式为:K= 。当上述反应达到平衡后 ,加入CCl4萃取I2,且温度不变,上述平衡 移动(选填:向右、向左、不)。
(2)上述反应的正向反应速率和I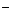 、Fe
、Fe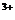 的浓度关系为:
的浓度关系为:
V=K[c(I-)]m[c (Fe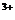 )]n(K为常数)
)]n(K为常数)
|
|
C (I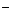 )mol/L )mol/L |
C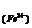 mol/L mol/L |
V(mol/L·S) |
|
(1) |
0.20 |
0.80 |
0.032K |
|
(2) |
0.60 |
0.40 |
0.144K |
|
(3) |
0.80 |
0.20 |
0.128K |
通过所给的数据计算得知:在V=K[c(I-)]m[c (Fe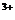 )]n中m n的值为 .
)]n中m n的值为 .
A.m=1 n=1 B.m=1 n=2
C.m=2 n=1 D.m=2 n=2
I-浓度对反应速率的影响 Fe3+浓度对反应速率的影响。(填:大于、小于、等于)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com