
1、(广东省中山一中2009届高三第二次统测化学试题)下表是食用碘盐包装上的部分说明,下列说法正确的是(A )
|
配料 |
精盐、碘酸钾、抗结剂 |
|
碘含量 |
35±15 mg/kg |
|
储存方法 |
密封、避光、防潮 |
|
食用方法 |
烹饪时,待食品熟后加入碘盐 |
A.高温会导致碘的损失 B.碘酸钾可氧化氯化钾 C.可用淀粉检验碘盐中的碘酸钾 D.该碘盐中碘酸钾含量为20-50 mg/kg
、 相同的分子具有相似的化学键特征,它们的许多性质是相近的,这叫做等电子原理。
试题枚举
[例1]关于化学键的下列叙述中,正确的是
A.离子化合物中可能含有共价键
B.共价化合物中可能含有离子键
C.离子化合物中只含离子键
D.共价键只能存在于化合物中
解析:离子键只存在于离子化合物中,共价键可存在于离子化合物、共价化合物以及某些单质中
答案: A
[例2]下列化合物中既存在离子键,又存在极性键的是
A.H2O B.NH4Cl C.NaOH D.Na2O2
解析:水分子中只有H-O键,是极性键,无离子键,排除A项;NH4Cl中NH4+和Cl-间是离子键,NH4+内N和H原子以极性键结合,B项正确;NaOH中Na+和OH-以离子键结合,OH-内H和O之间以极性键结合,C项正确;Na2O2中Na+和O22-以离子键结合,O22-内有非极性键,排除D项。
答案:B C。
[例3]下列分子中所有原子都满足最外层8电子结构的是
A.光气(COCl2) B.六氟化硫 C.二氟化氙 D.三氟化硼
解析:分子中的原子是否满足8电子结构,决定于中心原子的最外层电子数和形成共价键的数目
答案:A
[例4]对δ键的认识不正确的是( )
A.δ键不属于共价键,是另一种化学键
B.S-Sδ键与S-Pδ键的对称性相同
C.分子中含有共价键,则至少含有一个δ键
D.含有π键的化合物与只含δ键的化合物的化学性质不同
解析:共价键包括δ键和π键,δ键不管是S-Sδ键、S-Pδ键还是P-Pδ键都是轴对称的,π键不够稳定,必须与δ键共存
答案:A
[例5]下列分子中,键能最小的是
A.F2 B.Br2 C.Cl2 D.N2
解析:N2中含有一个三键,键能较大;F2、Br2、Cl2中只有一个单键,键能小,F2分子中电子“密度”大,F原子间斥力大,键能最小
答案:A
[例6]能够用键能解释的是( )
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应
D.硝酸易挥发,硫酸难挥发
解析:键能的大小影响键的稳定性,影响的是物质的化学性质(稳定性)
[例7]与NO3-互为等电子体的是( )
A.SO3 B.BF3 C.CH4 D.NO2
解析:等电子体要求原子总数相同、价原子总数相同,C、D原子总数不同,A价原子总数不同,选B
答案:B
键参数包括 、 、 ;其中 、 是衡量共价稳定性的参数,通常键长越 ,键能越大,表明共价键越稳定;共价键具有 性, 是描述分子立体结构的重要参数,分子的立体结构还与 有一定的关系。
|
 非极性共价键: 元素的原子间形成的共价键,共用电子对 偏向任何一个原子,各原子都
,简称
非极性共价键: 元素的原子间形成的共价键,共用电子对 偏向任何一个原子,各原子都
,简称
极性共价键: 元素的原子间形成的共价键,共用电子对偏向电负性 较 的一方,简称
|
 δ键:δ键的特征:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为
。常见的δ键有“s-sδ键”、
、
。
δ键:δ键的特征:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为
。常见的δ键有“s-sδ键”、
、
。
π键:π键呈 对称,常见的有“ π键”
思考:如何判断δ键和π键?δ键和π键的稳定性如何?
2.写出下列微粒的电子式:Al Mg2+ O2- OH- NH4+ CaCl2 CO2
2、离子键与共价键比较
|
键型 |
离子键 |
共价键 |
|
(1)概念 |
|
|
|
(2)成键微粒 |
|
|
|
(3)形成条件 |
|
|
|
(4)用电子式表示形成过程 |
|
|
思考:1.离子键、共价键分别存在于哪些种类的物质中?
1、概念: ,叫做化学键,根据成键原子间的电负性差值可将化学键分为 和 。旧的化学键的断裂和新的化学键的生成是化学反应的本质,也是化学反应中能量变化的根本。
16.SiO2+2NaOH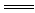 Na2SiO3+H2O
Na2SiO3+H2O
Na2SiO3+2HCl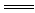 2NaCl+H2SiO3↓
2NaCl+H2SiO3↓
或Na2SiO3+CO2+H2O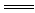 Na2CO3+H2SiO3↓
Na2CO3+H2SiO3↓
Na2SiO3+2CO2+2H2O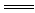 2NaHCO3+H2SiO3↓
2NaHCO3+H2SiO3↓
解析:SiO2难溶于水,不能与水发生反应,这样就只能先用SiO2与其他物质先作用生成硅酸盐,再根据硅酸是弱酸,用硅酸盐与酸作用来制备硅酸。
点评:一般来说,受热易分解的酸或碱,其对应的氧化物则不能与水反应,如H2SiO3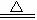 H2O+SiO2,则SiO2不能与水反应;Cu(OH)2
H2O+SiO2,则SiO2不能与水反应;Cu(OH)2 CuO+H2O,则CuO不能与水反应。硅酸不能溶于水,且不能溶于(HCl、H2SO4、HNO3等)强酸。不溶于强酸的物质还有:CuS、Ag2S、PbS、HgS、AgCl、AgBr、AgI、BaSO4等。
CuO+H2O,则CuO不能与水反应。硅酸不能溶于水,且不能溶于(HCl、H2SO4、HNO3等)强酸。不溶于强酸的物质还有:CuS、Ag2S、PbS、HgS、AgCl、AgBr、AgI、BaSO4等。
15.不矛盾;原因见上。
解析:本题利用CO2、SiO2、Na2SiO3、H2CO3、H2SiO3等化合物的性质,考查同学们的逻辑推理能力以及思维的敏捷性和深刻性。反应①是在溶液中进行的反应,反应之所以能够发生,是由于酸性H2CO3>H2SiO3,反应符合“强酸制弱酸”的复分解反应原理;而反应②是在高温熔融状态下的反应,由于CO2可从熔融体中逸出,使得反应可以发生,而与酸性H2CO3>H2SiO3无关。
点评:①是在水溶液中进行的复分解反应,②是固体与固体之间的反应(非水条件);①是常温下的反应,②是高温条件下的反应。两个反应的条件不同,实质上没有可比性,因为它们的反应原理、反应条件与本质均不同。
14.Na2SiO3 Si SiO2 CaSiO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com