
1.下列物质①煤油②油酸③石炭酸④福尔马林⑤脂肪⑥酚醛树脂,其中有固定沸点的是 ( )
A.②③ B.②④⑤
C.①③⑤ D.②③⑤⑥
(3)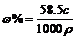 (4)
(4)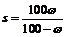 g
g
28.(1)0.08mol (2)6g
讲析:28.若以常规解法,需先写出四个氧化还原方程式,再按题意列式逐步计算,显然这种解法较繁,也更造成紧张的应试气氛。若能着眼于整体守恒,根据电子得失总数相等原理就不难发现:0.04molKMnO4中+7价锰变为Mn2+所得电子总量必等于生成amolO2和bmolCl2时失电子的总量,即0.04×(7-2)=4a+2b。因产生1molO2所需同电子多于产生1molCl2所需电子,因此当KMnO4完全分解a=0.02mol时,(a+b)有最小值(0.08mol)。再根据质量守恒又可迅速求出残留固体质量为6g。
26.(1)①镁片上有大量的气泡产生;②镁片逐渐溶解;③烧杯中析出晶体;(2)镁与盐酸反应产生氢气,该反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,故析出Ca(OH)2晶体,(3)Mg+2H+=Mg2++H2↑ (4)小于
(4)枯水期水量小,流速慢,水中含营养元素质量分数大,有利于藻类迅速生长。24.CO32-;SO42-、OH-、Cl-;NO3-。Ba2++co32-=BaCO3↓ BaCO3+2H+=Ba2++H2O+CO2↑
Ca2++2OH-+CO2=CaCO3↓+H2O
讲析:23.求该物质的式量,可假设分子中含量较少的P原子只有1个,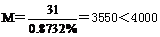 ,符合题意,然后根据式量和各原子含量再求各原子个数。
,符合题意,然后根据式量和各原子含量再求各原子个数。
24.实验①可推知溶液可能含有CO32-、OH-;实验②证明有CO32-而无SO42-,实验③证明溶液中无OH-、Cl-,因为OH-能与Ag+反应。
|
|||
|
|||
22.(1)① ②
(2)①H3PO3+2NaOH=Na2HPO3+2H2O
②H3AsO3+3NaOH=Na3AsO3+3H2O (3)只有亚砷酸发生反应As(OH)3+3HCl=AsCl3+3H2O
讲析:21.Pb3O4可写成PbO2·2PbO,其中+4价Pb能将Mn2+氧化成MnO4-。22.亚磷酸是中强酸,则应有1个非羟基氧原子,有1个氢原子直接与磷原子相连,因此亚磷酸虽然有3个氢原子,但为二元酸。亚砷酸没有非羟基氧原子,且有两性,因此它能与HCl反应生成AsCl3。
讲析:9.题干中给出的几种氧化物均为酸酐,与水反应只能生成相应的酸,而NO2与水反应除生成HNO3外还生成NO,CO,NO不能与水反应,N2O3是HNO2的酸酐。
13.设原溶液中KNO3为x,则由x/(140-70)=(x+30)/(140+30)得x=21g,原溶液的质量分数 (KNO3)=21g/140g×100%=15%。15.0.1molNa2O、Na2O2与水反应所得的溶质质量相等,溶液质量也相等,则它们溶质质量分数相等;CaO与水反应生成Ca(OH)2,由于Ca(OH)2微溶,所得溶液质量分数比NaOH小。17.分析CrO5的结构不难发现Cr为+6价,有4个O为-1价,因此题中反应不是氧化还原反应。
(KNO3)=21g/140g×100%=15%。15.0.1molNa2O、Na2O2与水反应所得的溶质质量相等,溶液质量也相等,则它们溶质质量分数相等;CaO与水反应生成Ca(OH)2,由于Ca(OH)2微溶,所得溶液质量分数比NaOH小。17.分析CrO5的结构不难发现Cr为+6价,有4个O为-1价,因此题中反应不是氧化还原反应。
讲析:1.①④⑤⑥为混合物,②③为纯净物。2.爆炸可能是由于气体急剧膨胀引起,不一定要发生化学反应。5.硝酸铵,氯酸钾受热易分解且放出气体,火棉易燃易爆,汽油易燃。7.CaOCl2应写成Ca(ClO)Cl,含两种酸根ClO-、Cl-;B为复盐;D为络盐;C中只有一种是酸根。
12.设A=[-1,1],B=[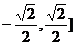 ,函数f(x)=
,函数f(x)= ,
,
a)
若对任意的 ,都有f(x+1)=f(1-x)成立,试求
,都有f(x+1)=f(1-x)成立,试求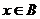 时f(x)的值域;
时f(x)的值域;
b)
设不等式 的解集为C,当C
的解集为C,当C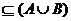 时,求实数m的取值范围;
时,求实数m的取值范围;
c)
当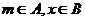 时,证明:
时,证明: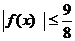 。
。
11. 用一根长为100m的绳子能围成一个面积大于600m2的 矩形吗?当长宽各为多少米时,所围成的面积最大?
10.设 ,
,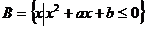 ,A∩B=
,A∩B=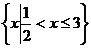 ,求
,求 的取值范围.
的取值范围.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com