
12.某学生将H2O2(具有弱酸性)滴入含有酚酞的氢氧化钠溶液中,观察到溶液的红色消失。为了证明溶液褪色的实质:H2O2中和氢氧化钠(或H2O2氧化酚酞)使得溶液褪色。若在溶液中再加入一种试剂,通过观察现象就可判断其实质,其试剂为 ( )
A.盐酸至过量 B.NaOH溶液至过量 C.品红 D.MnO2
11.钾是活泼的碱金属,钾和氧气反应时可以生成氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物,现将钾与氧气在一定条件下的反应产物1.1g溶于水,所得溶液用0.5mol/L的HCl溶液进行滴定,终点时消耗HCl溶液40.00mL,则钾与氧气反应产物的成份可能是
A.K2O B.KO2 C.K2O和K2O2 D.K2O和KO2
10.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体为纯净物的是 ( )
A.Na2SO3溶液和过量氧气 B.等物质的量的NaHCO3和Na2O2固体
C.FeSO4溶液和过量溴水 D.溶质的物质的量相同的(NH4)2SO4溶液和BaCl2溶液
9.下列各组物质相互混合进行反应,既有气体生成最终又有沉淀生成的是
A.金属钠投入CuSO4溶液中 B.少量的Na2O2溶液和明矾溶液反应
C.少量澄清石灰水投入过量的NaHCO3溶液中 D.金属铝投入KOH溶液中
8.下列装置或操作能达到实验目的的是 ( )



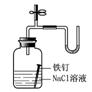
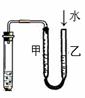

|

 A.①②③④ B.③④ C.②③④
D.①②
A.①②③④ B.③④ C.②③④
D.①②
7.下列离子方程式书写正确的是( )
A.硫酸铝溶液中滴加过量浓氨水:Al3++4OH-=AlO +2H2O
+2H2O
B.NaHCO3溶液水解:HCO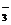 +H2O=H2CO3+OH-
+H2O=H2CO3+OH-
C.浓氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO +H2O
+H2O
D.向小苏打溶液中加入醋酸溶液:HCO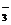 + H+ = CO2↑+ H2O
+ H+ = CO2↑+ H2O
6.在下列溶液中,各组离子一定能够大量共存的是
A.pH=2的溶液: Fe3+、Cu2+、SO42-、NO3-
B.c(H+)=1×10-12mol/L的溶液:NH4+、K+、Cl-、AlO2-
C.水电离的c(H+)=1×10-12mol/L的溶液:Na+、Al3+、Br-、ClO- 
D.与铝反应放出氢气的溶液:Na+、Mg2+、Br-、Cl- 
5.某单质X能从含元素Y的盐溶液中置换出Y单质,由此可知( )
A.当X、Y均为金属时,X一定比Y活泼 B.当X、Y均为非金属时,Y一定比X活泼
C.当X是金属时,Y一定是金属
D.当X是非金属时,Y可能是金属,也可能是非金属
4.设阿伏加德罗常数的值为NA。下列叙述正确的是
A.1.0L0.1mol/L的NH4Cl溶液中NH4+的个数为0.1NA
B.标准状况下11.2 L NH3溶于1 L水中,溶液中含N原子的微粒总数为0.5 NA
C.常温下,0.05mol CO2和SO2混合气体中所含氧原子数为0.1NA
D.高温高压下,1.4 g N2与0.3 g H2反应,生成的NH3分子数为0.1NA
3. 已知在25℃,101kPa下,l g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ
热量。表示上述反应的热化学方程式正确的是( )
A .C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(g); △H=-48.40kJ·mol-1
B.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1); △H=-5518kJ·mol-1
C.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1) ;△H=+5518kJ·mol-1
D.C8H18(1)+12.5O2(g)=8CO2(g)+9H2O(1); △H=-48.40kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com