
16.(1)温度较低(2分)
(2)2NaCl + 2H2O
 2NaOH + H2↑ + Cl2↑(2分)
2NaOH + H2↑ + Cl2↑(2分)
(3)Fe元素的化合价显+6价,易得电子(2分)
(4)10 mol/L(2分)(5)AC(2分)
(6)KNO3 KCl, KNO3可用于化肥,炸药等(合理就给分)(2分)
15.(1)
用铂丝蘸取盐酸溶液,在火焰上灼烧至无色,再蘸取少许试验溶液在火焰上灼烧,火焰呈黄色,即证明含有Na+。(直接答成“焰色反应”不得分。2分)
(2)
(Ⅰ)5NaClO2+4HCl=4ClO2+5NaCl+2H2O;2ClO2+10I-+8H+ = 2Cl-+5I2+4H2O(各2分)
(Ⅱ)用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等;( 1分)
导管中无黄绿色气体( 1分)。
(Ⅲ) .(2分)
.(2分)
20.海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。
 (1)在光照条件下,氯气和氢气反应过程如下:
(1)在光照条件下,氯气和氢气反应过程如下:
 ①Cl2
①Cl2 Cl+Cl ②Cl+H2
Cl+Cl ②Cl+H2 HCl+H ③H+Cl2
HCl+H ③H+Cl2 HCl+Cl……
HCl+Cl……
 反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属
反应②中形成的化合物的电子式为 ;反应③中被破坏的化学键属 于
键(填“极性”或“非极性”)。
于
键(填“极性”或“非极性”)。
 (2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是
(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是  (用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
(用元素符号表示)。与氯元素同周期且金属性最强的元素位于周期表的第 周期 族。
 (3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是 。
 a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
a.卤化银的颜色按AgCl、AgBr、AgI 的顺序依次加深
 b.卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小
b.卤化氢的键长按H-F、H-C1、H-Br、H-I的顺序依次减小
 c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
c.卤化氢的还原性按HF、HCl、HBr、HI的顺序依次减弱
 d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
d.卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由难变易
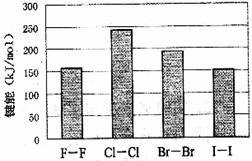
 (4)卤素单质的键能大小如右图。由图推断:
(4)卤素单质的键能大小如右图。由图推断:
 ①非金属性强的卤素,其单质分子的化学键
①非金属性强的卤素,其单质分子的化学键
 断裂(填“容易”或“不容易”或“不一定容易”)。
断裂(填“容易”或“不容易”或“不一定容易”)。
 ②卤素单质键能大小与键长的关系为:
。
②卤素单质键能大小与键长的关系为:
。
19. 聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种
聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种
高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如上图所示。 填空:
填空:
(1)搅拌加热操作过程中发生反应的离子方程式 ;
;
(2)生产过程中操作B和D的名称均为 (B和D为简单操作);
(3)反应中副产品a是 (用化学式表示);
(4)生产过程中可循环使用的物质是 (用化学式表示);
(5)调节pH至4.0-4.5的目的是 ;
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净,生产过程中C物质可选用 。
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
18.铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
[探究一]实验方案:铝镁合金 测定剩余固体质量
测定剩余固体质量
实验中发生反应的化学方程式是
实验步骤:
(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L-1NaOH溶液中,充分反应。NaOH溶液的体积V≥
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
 (填“偏高”或“偏低”)。
(填“偏高”或“偏低”)。
[探究二]实验方案:铝镁合金 测定生成气体的体积。实验装置如右图:
测定生成气体的体积。实验装置如右图:
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个干燥、除酸雾的装置。你的意见是: (填“需要”或“不需要”)。
 (2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):①
②
。
(2)为使测定结果尽可能精确,实验中应注意的问题是(写出两点):①
②
。
[探究三]实验方案:称量x g铝镁合金粉末.放在如右图所示装置的惰性电热板上,通电使其充分灼烧。
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是 。
(2)若用空气代替O2进行实验,对测定结果是否有影响? (填“是”或“否”)。
[实验拓展]参照探究一、探究二实验方案,请你另设计一个实验方案,测定该铝镁合金中镁的质量分数。
。
17.铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
[提出猜想]
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 中的一种或两种。
[实验探究]
|
|
实验操作 |
预期现象 |
结 论 |
|
验证猜想Ⅰ |
步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液 |
|
|
|
步骤②: |
|
含有Fe3+ |
|
|
验证猜想Ⅱ |
将所得气体通入如下装置 |
|
含有两种气体 |



[问题讨论]
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,请对该观点进行评价:
。
16.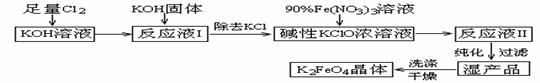 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在_______________(填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式___________________________________________;
(3)K2FeO4具有强氧化性的原因 _______________________________________________;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为______________________________;
(5)在“反应液I”中加KOH固体的目的是:_____________
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物 D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 ________________________(写化学
式),它们都是重要的化工产品,具体说出其中一种物质的用途______________________。
15. “稳定性二氧化氯溶液”是淡黄色透明液体,广泛应用于食品卫生等领域的杀菌消毒。ClO2沸点11℃,是一种黄绿色的气体,易溶于水。ClO2稳定性较差,“稳定性二氧化氯溶液”是以碳酸钠为稳定剂,有效成分为NaClO2。
 某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(样品与酸反应产生二氧化氯的质量/样品质量)。请回答下列问题:
某合作学习小组的同学拟证实其中的有效成分并测定二氧化氯的含量(样品与酸反应产生二氧化氯的质量/样品质量)。请回答下列问题:
 (1)为证实“稳定性二氧化氯溶液”中含有钠离子,其正确的操作步骤是:_________
(1)为证实“稳定性二氧化氯溶液”中含有钠离子,其正确的操作步骤是:_________
____________________________________________________________________________
____________________________________________________________________________。
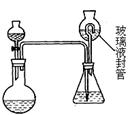
 (2)为测定“稳定性二氧化氯溶液”中二氧化氯的含量,现进行以下操作:①取mg(2g左右)
(2)为测定“稳定性二氧化氯溶液”中二氧化氯的含量,现进行以下操作:①取mg(2g左右) 试样,置于烧瓶中,向分液漏斗中加入10mL盐酸溶液;②在锥形瓶中加入4g碘化钾,用100mL水溶解后,再加3mL硫酸溶液;③在玻璃液封管中加入水;④将分液漏斗中的盐酸溶液放入烧瓶中,关闭旋塞。缓慢加热烧瓶,使产生的二氧化氯气体全部通过导管在锥形瓶中被吸收;⑤将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定至蓝色消失(I2+2S2O32-=2I- +S4O62-),共用去VmL硫代硫酸钠溶液。
试样,置于烧瓶中,向分液漏斗中加入10mL盐酸溶液;②在锥形瓶中加入4g碘化钾,用100mL水溶解后,再加3mL硫酸溶液;③在玻璃液封管中加入水;④将分液漏斗中的盐酸溶液放入烧瓶中,关闭旋塞。缓慢加热烧瓶,使产生的二氧化氯气体全部通过导管在锥形瓶中被吸收;⑤将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定至蓝色消失(I2+2S2O32-=2I- +S4O62-),共用去VmL硫代硫酸钠溶液。
 (Ⅰ)NaClO2与盐酸反应生成ClO2(还原产物为Cl-),该反应的化学
(Ⅰ)NaClO2与盐酸反应生成ClO2(还原产物为Cl-),该反应的化学 方程式为: ________________________________________________________ ;
方程式为: ________________________________________________________ ;
ClO2通入锥形瓶与酸性碘化钾溶液反应,  二氧化氯被还原为氯离子,
二氧化氯被还原为氯离子,
该反应的离子方程式为:_______________________________________。
 (Ⅱ)装置中玻璃液封管的作用是:______________________________;
(Ⅱ)装置中玻璃液封管的作用是:______________________________;
如何确定烧瓶中 的二氧化氯全部被锥形瓶中的液体吸收____________
的二氧化氯全部被锥形瓶中的液体吸收____________
___________________________________________________________。
 (Ⅲ)“稳定性二氧化氯溶液”中,ClO2的质量分数为 ___________________________
(Ⅲ)“稳定性二氧化氯溶液”中,ClO2的质量分数为 ___________________________
 (用m、c、V表示)。
(用m、c、V表示)。
14.将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如右图所示。则下列说法不正确的是 ( )
 A.镁和铝的总质量为9 g
A.镁和铝的总质量为9 g
B.最初20 mLNaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol·L–1
D.生成的氢气在标准状况下的体积为11.2 L
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
|
|
|
|
|
|
|
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|
|
|
|
|
|
|
|
Ⅱ卷(非选择题 共72分)
13.用下图装置制取、提纯并收集表中的四种气体(a、b、c、d表示相应仪器中加入的试剂),其中可行的是 ( )
|
|
气体 |
a |
b |
c |
 d d |
|
A |
O2 |
双氧水 |
MnO2 |
浓硫酸 |
浓硫酸 |
|
B |
SO2 |
浓盐酸 |
Na2SO3 |
NaHCO3溶液 |
酸性KMnO4溶液 |
|
C |
NH3 |
浓氨水 |
生石灰 |
碱石灰 |
浓硫酸 |
|
D |
Cl2 |
浓盐酸 |
MnO2 |
浓硫酸 |
NaOH溶液 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com