
3.给下列诗句划分朗读节奏。
肉体虽早已腐朽化为乌有,
生之灵却悄然潜行在地下。
黑色的躯壳裹藏着生命的信息,
为历史留下一本珍贵的密码。
2.改正成语中的错别字。
事在必行( ) 其貌不洋( ) 坐想其成( )
以逸代劳( ) 故技重演( ) 针贬时弊( )
言不由中( ) 出神入画( )
1.解释词语。
(1)腐朽:
(2)化为乌有:
(3)潜行:
(4)海枯石烂:
(5)葱茏:
(6)叹服:
270. B0.5mol/L一元弱酸A和未知浓度的一元强碱B以1:2体积比混合,所得溶液的c(OH-)=0.1mol/L,用B中和20mL一元弱酸C(该酸溶液c(H+)=0.01mol/L)当恰好完全反应时,用5mLB溶液。求弱酸C的电离度。
269. A某温度下,在500 mL 0.01mol/L CH3COOH溶液中含CH3COOH、H+、CH3COO-共3.13×1021个,求该温度下,此溶液中CH3COOH的电离度。
268. A弱酸和它们的盐或弱碱和它们的盐组成的混合物的溶液称为缓冲溶液。缓冲溶液具有抵抗外来少量酸或碱的干扰,使溶液的pH值基本保持不变(缓冲作用),人们血液中的缓冲作用的缓冲对是H2CO3(弱酸)和HCO3-(弱酸盐),缓冲作用的原理可表示为:HCO3-+H+=H2CO3; H2CO3+OH-=HCO3- +H2O
(1)含有一定量HAc和 NaAc的水溶液也具有缓冲作用,写出在此过程中加入酸或碱的离子反应方程式为:
加入酸_________________________;
加入碱 。
(2)请写出另外可以形成缓冲溶液的两组物质:
, 。
267. B用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.l mol/L的溶液100 mL;
② 用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100 mL;
② 分别取这两种溶液各10 mL,加水稀释为100 mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(填“>”、“<”或“=”)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处 、
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
266. B已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
|
①H2SO4溶液: HSO4- 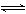 H++SO42- H++SO42- |
②NaHSO4溶液: HSO4- 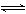 H++SO42- H++SO42- |
③醋酸溶液 CH3COOH 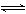 CH2COO+H+ CH2COO+H+ |
④盐酸 HCl=H++Cl |
|
10% |
29% |
1.33% |
100% |
⑴25℃时,0.1mol/L上述几种溶液中[H+]由大到小的顺序是 (填序号,下同)
⑵25℃时,[H+]相同的上述几种溶液,其物质的量浓度由大到小的顺序是
⑶25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是
265. B 与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 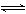 NH4++NH2-
NH4++NH2-
(1)据此判断以下叙述中错误的是 ( )
A.液氨中含有NH3、NH4+、NH2-等微粒
B.一定温度下液氨中c(NH4+)·c (NH2-)是一个常数
C.液氨的电离达到平衡时c (NH3) =c (NH4+) = c (NH2-)
D.只要不加入其他物质,液氨中c (NH4+) = c (NH2-)
(2)完成下列反应方程式
①在液氨中投入一小块金属钠,放出气体----------------------------
②NaNH2溶于水的反应----------------------------------
③类似于“H++OH-=H2O”的反应----------------------------
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com