
3.影响水的电离度大小的因素:
(1)温度的影响规律:升高温度,水的电离度 .
(2)浓度的影响规律:
①加入酸, c(H+)增大,水的电离平衡向 移动,水的电离度 。
②加入碱, c(OH-)增大,水的电离平衡向 移动,水的电离度。
③加入因水解而使溶液呈酸性或呈碱性的盐,使水的电离度 。
④加入因电离而使溶液呈酸性的酸式盐, 如:NaHSO4、NaHSO3和NaH2PO4等,相当于加入酸的作用,使水的电离度 。
|
[特别提醒]:水的离子积不仅适用于纯水,还适用于稀的电解质溶液。 |
[例1]向纯水中加入少量的KHSO4固体(温度不变),则溶液的( ) A、pH值升高 B、[H+]和[OH-]的乘积增大 C、酸性增强 D、OH-离子浓度减小
考点2 溶液的酸碱性和pH值
2.水的电离度
对于水 c(H2O)=(1000g/L)/(18g/mol) = 55.56mol/L(常数).
常温时 α水=10-7/55.6=1.8×10-9=1.8×10-7%
所以水是 的电解质.比水还难电离的物质通常看作是非电解质.
1.水的电离平衡和电离平衡常数
H2O + H2O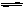 H3O+ + OH- ΔH>0 或者 H2O
H3O+ + OH- ΔH>0 或者 H2O
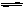 H+ + OH-
ΔH>0
H+ + OH-
ΔH>0
①25℃时:KW= =10-14mol·L-1
②Kw随温度升高而
1.“研讨与练习”一。
11.愿你珍重 。
10. 使人回味无穷。
9.第一次看到 ,但觉 。
8. 玲珑剔透。
7. 给 留下了不可磨灭的印象。
6. 值得低回品味。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com