
2.在溶液中能与Fe3+共存的微粒是( )
A.Cu B.S2- C.CO32- D.Fe2+
1.用生铁冶炼成碳素钢的主要目的是( )
A.把生铁提纯,除去生铁中杂质 B.加入各种元素,改善生铁的性能
C.用还原剂把氧化亚铁还原成铁 D.适当降低生铁里的含碳量,除去大部分硫、磷等杂质
4. (12)硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2-3遍;
②向洗涤过的废铁屑加入过量的稀硫酸,控制温度50-80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水2-3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广囗瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是__________________,加热的作用是____________________。
(2)实验步骤②明显不合理,理由是_______________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是_____________;_______________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7℃、64℃温度下可同时析出两种晶体)。
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
||
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
|||||||||
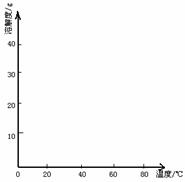 请根据表中数据作出硫酸亚铁的溶解度曲线。
请根据表中数据作出硫酸亚铁的溶解度曲线。
⑤若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制的结晶温度(t)的范围为____________________
思维方法:
展望高考:
[针对训练]
A . 基础训练
3.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn + 2K2FeO4 + 8H2O
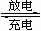 3Zn(OH)2 + 2Fe(OH)3
+ 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3
+ 4KOH,下列叙述不正确的是
A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B、充电时阳极反应为:Fe(OH)3 -3e-+5OH-=FeO42-+4H2O
C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D、放电时正极附近溶液的碱性增强
思维方法: 。
展望高考:
2.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是
A、3Cl2+6FeI2=2FeCL3+4FeI3 B、Cl2+FeI2=FeCl2+I2
C、Co2O3+6HCl=2CoCl2+Cl2↑+3H2O D、2Fe3++2I-=2Fe2++I2
思维方法: 。
展望高考:
1.下列有关纯铁的描述正确的是 ( )
A.熔点比生铁的低 B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在潮湿空气中比生铁容易被腐蚀 D.在冷的浓硫酸中可钝化
思维方法: 。
展望高考:
10.铁与稀硝酸反应的规律
(1) 当n(Fe)/n(HNO3)时,发生的反应是:
(2) 当n(Fe)/n(HNO3)≥3∕8 时,发生的反应是:
(3)
当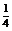 <
<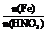 <
<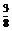 时,发生的反应是:
时,发生的反应是:
[例题解析]
[例1]下列物质发生反应时其离子方程式正确的是
A.铁与三氯化铁溶液反应:Fe+Fe3+=2Fe2+
B.足量的氯气通入溴化亚铁溶液中:
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C. Fe(OH)3跟盐酸反应:Fe(OH)3+3H+=Fe3++3H2O
D. FeS跟稀哨酸反应:FeS+2H+=Fe2++H2S
解题思路: 。
易错点: 。
[例2]在烧制砖瓦时,用粘土做成的坯经过烘烧后,铁的化合物转化成 而制得红色砖瓦。若烘烧后期从窑顶向下慢慢浇水,窑内会产生大量的 气体,它们把该红色物质还原成的黑色化合物是 ,同时还有未烧的碳颗粒,而制得了青色砖瓦。
解题思路: 。
易错点: 。
[例3]固体A和B都由两种相同的元素组成。在A、B中两种元素的原子个数比分别为1∶1和1∶2。将A和B在高温下煅烧时,产物都是固体C和气体D。由D最终可制得酸E。E的稀溶液跟A反应时生成气体G和溶液F。G和D在常温下混合有浅黄色固体生成。在F中滴加溴水后,再加入KOH溶液,有红褐色沉淀生成,给沉淀加热时又能转变成C。根据上述事实回答:
(1)A的化学式是 ,B的化学式是 。
(2)B锻烧生成C和D的化学方程式是 。
(3)G与D混合发生反应的化学方程式是 。
(4)在F中滴加溴水的化学方程式是 。
(5)A与E反应的离子方程式是 。
解题思路: 。
易错点: 。
[例4]冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或氢气,或一氧化碳)法③活泼金属置换法;④电解法。四种方法在工业上均有应用。古代有(I)火烧孔雀石炼铜;(II)湿法炼铜;现代有(III)铝热法炼铬;(IV)从光卤石中炼镁,对它们的冶炼方法的分析不正确的是
A. (I)用① B. (II)用② C. (III)用③ D. (IV)用④
解题思路: 。
易错点: 。
[考题再现]
9。Fe2+和Fe3+的鉴别方法
8.铁的氢氧化物
|
化学式 |
Fe(OH)2 |
Fe(OH)3 |
|
颜色 状态 |
|
|
|
溶解性 |
|
|
|
稳定性 |
|
|
|
与H+反应 |
|
|
|
转化关系 |
|
|
7.常见的铁的氧化物有哪几种?列表比较其物理化学性质上的异同点:
|
化学式 |
FeO |
Fe2O3 |
Fe3O4 |
|
颜色状态 |
|
|
|
|
溶解性 |
|
|
|
|
铁的化合价 |
|
|
|
|
稳定性 |
|
|
|
|
与H+反应 |
|
|
|
|
铝热反应 |
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com