
4.由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。则该混合气体中CO2、H2和CO的体积比为 ( )
A.29:8:13 B.22:l:14 C.13:8:29 D.26:16:57
3.由钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为 ( )
A.2:l B.1:l C.1:2 D.1:3
2.下列各组中两种气体的分子数一定相等的是 ( )
A.温度相同、体积相同的O2和N2 B.质量相等、密度不等的N2和C2H4
C.体积相同、密度相等的CO和C2H4 D.压强相同、体积相同的O2和H2
1.质量相等的两份气体样品,一份是CO,另一份是CO2,这两份气体样品中,CO与CO2所含氧原子的原子个数之比是 ( )
A.1:2 B.1:4 C.11:14 D.1l:28
氢键是除范德华力外的另一种 ,它是由已经与电负性很强的原子形成共价键的氢原子与 中电负性很强的原子之间的作用力;氢键不仅存在于分子与分子之间,也可存在于分子内。与化学键相比,氢键是一种较弱的作用力,但比范德华力大。
试题枚举
[例1]下列变化中,不存在化学键断裂的是
A.氯化氢气体溶于水
B.干冰气化
C.氯化钠固体溶于水
D.氢气在氯气中燃烧
解析:氯化氢气体溶于水,电离出H+和Cl-,原有的共价键被破坏;氯化钠固体溶于水,氯化钠固体中不能自由移动的Na+和Cl-变成能够自由移动,原有的离子键被破坏;干冰是由分子构成的,气化时只要克服分子间作用力,不要破坏分子内的化学键;氢气在氯气中燃烧是化学变化,必然有化学键的断裂。
答案: B
[例2]下列实验事实不能用氢键来解释的是
A.冰的密度比水小,能浮在水面上
B.接近沸点的水蒸气的相对分子质量测量值大于18
C.邻羟基苯甲醛的沸点低于对羟基苯甲醛
D.H2O比H2S稳定
解析:氢键使冰晶体中的水分子呈一定规则排列,空间利用率低,密度小;氢键使接近沸点的水蒸气中含有少量(H2O)2;邻羟基苯甲醛存在分子内氢键,而对羟基苯甲醛存在分子间氢键,增大了分子间作用力,沸点较高。H2O比H2S稳定是因为H-O比H-S稳定
答案:D。
[例3]下列物质中分子间能形成氢键的是
A.N2 B.HBr C.NH3 D.H2S
解析:A-H……B,A、B为N、O、F
答案:C
[例4]试从不同角度解释:乙醇(C2H5OH)和二甲醚(CH3OCH3)的化学组成均为C2H6O,但乙醇的沸点为78.5℃,而二甲醚的沸点为-23℃?
解析:乙醇(C2H5OH)和二甲醚(CH3OCH3)的化学组成相同,两者的相对分子质量也相同,不同的是二者的极性、对称性不同,且乙醇能满足氢键的形成条件,从不同点加以解释。
答案:①乙醇的极性强,分子间作用力大,沸腾时需要提供更多的能量去破坏分子间作用力②乙醇分子之间能形成氢键,使分子间产生了较强的结合力,沸腾时需要提供更多的能量去破坏分子间氢键,而二甲醚分子间没有氢键,上述两点使乙醇的沸点比二甲醚的高。
3.分子间作用力对物质性质的影响
分子间作用力主要影响物质的物理性质,如 、 等
2.影响分子间作用力大小的因素:
(1)组成与结构相似的物质,相对分子质量 ,分子间作用力越大
(2)分子的极性越大,分子间作用力
(3)分子的空间构型:一般来说,分子的空间型越对称,分子间作用力越小
1.概念:分子间作用力又称 ,是广泛存在于分子与分子之间的较弱的电性引力,只有分子间充分接近时才有分子间的相互作用存在。
1.(08山东实验中学一诊)(5分)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及其物质的量浓度,进行以下实验:
①量取25.00 mL甲溶液,向其中缓慢滴入乙溶液15.00 mL,共收集到224 mL(标准状况)气体。②量取15.00 mL乙溶液,向其中缓慢滴入甲溶液25.00 mL,共收集到112 mL(标准状况)气体。
(1)判断:甲是____ ____溶液,其物质的量浓度为 mol·L-1。
(2)实验②中所发生反应的离子方程式为_______________________ _____ 。
答案) (1) HCl (1分) , 0.8 mol·L-1(2分)
(2)CO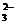 +H+ ==== HCO
+H+ ==== HCO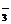 (1分) HCO
(1分) HCO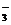 +H+ ==== CO2↑+H2O(1分)
+H+ ==== CO2↑+H2O(1分)
16.(08山东省滨州市三检)下列说法正确的是 ( C )
A.常温常压下,16g14CH4所含中子数为8NA
B.等物质的量浓度的HCl溶液与乙酸溶液中的c(H+)相等
C.乙酸分子与甲酸甲酯分子中的共价健数相等
D.等温等压下,3molC2H2(g)和1molC6H6(g)的密度相等
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com