
28.(1)根据NaCl的晶体结构分析,若取1mol该晶胞,则有4molFexO.
即:(4.28×10-8cm)3×6.02×1023mol-1×5.71g·cm-3=4(56x+16)g·mol-1
x=0.92
(2)设0.92个Fe原子中Fe2+有n个
由电荷守恒:2n+3(0.92-n)=1×2
n=0.76
则Fe2+所占的分数: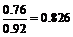 。
。
(3)由晶体的立体结构分析,与O2-等距且最近Fe占据空隙为八面体结构。
(4) 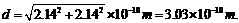
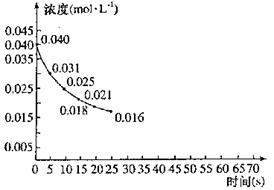
(2)(3)曲线分别为:
(4)K=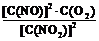
28.(1)0.92 (2)0.826 (3)八面体 (4)3.03×10-10m
讲析:27.(1)V(O2)=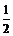 V(NO2)
V(NO2)
=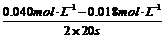

(2)45s达平衡,平衡后NO2浓度保持不变。
(3)加催化剂不影响平衡,但能缩短达平衡所需的时间。
26.(1)大 (2)①2K+2H2O=2K++2OH-+H2↑
②Mg2++2OH-=Mg(OH)2↓ ③Al3++3OH-=Al(OH)3↓
④Al(OH)3+OH-=AlO2-+2H2O
讲析:25(1)③中压强最大,C物质百分含量最大;①中温度最高,体积与②相同,反应进行的程度最小,则C物质百分含量最小。(2)假定③中开始不充入C,则达平衡时体积小于②,B的转化率较大,若冲入的C不参与反应,当③的体积与②相同时,B的转化率相同,当C再多时,使体积增大,平衡逆向移动,则B的转化率减小。实际上C的冲入使B的转化率更小。(3)压强相同,只要按a:b=3:1冲入,C的百分含量就相同。
26综合各实验现象以及原子结构知识可判断A、B、C、D分别为Na、Mg、Al、K。A、B、C加入冷水发生的反应为:2Na+2H2O=2NaOH+H2↑,
2Al+2NaOH+2H2O=2NaAlO2+2H2↑沉淀甲中有Mg,可能还有未反应的Al;加盐酸后的溶液丙中有MgCl2还可能有AlCl3。

氚-3H。(3)离子,离子晶体, ,
极性。
25.(1)③②① (2)> (3)a=3b
22.A、活化分子发生有效碰撞,才发生化学反应。B、增大压强即增加浓度,只能提高活化分子的总数。C、化学平衡是动态平衡。E、升高温度正逆反应速率都增大,只是v(正)>v(逆)。G、I2(g)的浓度因容器体积缩小而变大。
23.(1)正逆反应速率,各反应物和生成物的浓度,正逆反应,动态。
(2)放热,N2(g)+3H2(g) 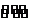 2NH3(g),ΔH=-92.4KJ/mol。
2NH3(g),ΔH=-92.4KJ/mol。
(3)加快反应速率,并且催化剂在这个温度时活性最大。
(4)正反应方向,不。
讲析:21.晶体氩是由原子构成的分子晶体;水晶、金刚石为原子晶体受热熔化时共价健被破坏。
22.DFG
15.A 16.A 17.BD 18.AC 19.BD 20.C
讲析:9.RO3-为ClO3- 10.同主族由上到下的顺序为:ZYX 12.Na2O2中离子键、共价健;石墨中有共价键、范德华力;白磷晶体有共价键、范德华力。14.X为P元素。 15.只要根据反应判断即可,①③两反应正反应皆为放热反应,正反应方向均为气体体积缩小的方向。 16.Z中发生反应为2NO2(g)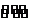 N2O4(g),压缩时所做的功小于甲中所做的功。 17.升高温度平衡正向移动;增大压强平衡逆向移动。 18.从反应物全部生成生成物或从生成物全部转变成反应物判断:0<X2<0.2、0.2<Y2<0.4、0<Z<0.4。 20.第一个容器中压强大、转化率大,放出热量较多,
N2O4(g),压缩时所做的功小于甲中所做的功。 17.升高温度平衡正向移动;增大压强平衡逆向移动。 18.从反应物全部生成生成物或从生成物全部转变成反应物判断:0<X2<0.2、0.2<Y2<0.4、0<Z<0.4。 20.第一个容器中压强大、转化率大,放出热量较多,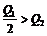 ,但Q1应小于197KJ。
,但Q1应小于197KJ。
讲析:1.因同种元素的原子可以构成不同单质(同素异形体),故A、B不正确。对D可以从FeCl2与FeCl3,Na2O与Na2O2判断。3.每种镁的同位素可以构成三种化学式,如24Mg35Cl2、24Mg37Cl2、24Mg35Cl37Cl,这样共有9种化学式,但其式量有相同的,共有7种式量。5.当温度由20℃升高到50℃时,VA=5mol/L•s×23=40mol/L·s,此时VC=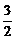 VA=60mol/L·s。
VA=60mol/L·s。
26、(8分)
(1)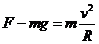 -----(1分)
-----(1分)
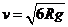 --------1分
--------1分
(2)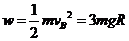 --------1分
--------1分
(3)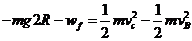 ---1分
---1分 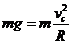 -----1分---
-----1分---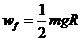 --1分
--1分
(4)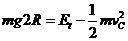 -------1分
-------1分 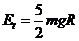 ----------------1分
----------------1分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com