
2、站在电梯中的人,当电梯竖直向上减速运动时,下列说法正确的是( )
A.人处于超重状态
B.电梯对人的支持力小于人对电梯的压力
C.电梯对人的支持力小于人的重力
 D.电梯对人的支持力与人的重力是一对平衡力
D.电梯对人的支持力与人的重力是一对平衡力
1、下列说法中,正确的是( )
A.国际单位制力学基本单位是:牛、千克、米
B.一对作用力与反作用力一定是同性质的力,一对平衡力可以是不同性质的力
C.物体不受力作用时才有惯性,一旦受力,运动状态将改变,也就失去了惯性
D.在相同力作用下获得加速度小的物体惯性小
28. (12分)已知FexO晶体晶胞结构为NaCl型(其晶胞的一个面如图),由于晶体缺陷,X值小于1。测知FexO晶体密度ρ为5.71g·cm-3,晶胞边长为4.28×10-10m。求
(12分)已知FexO晶体晶胞结构为NaCl型(其晶胞的一个面如图),由于晶体缺陷,X值小于1。测知FexO晶体密度ρ为5.71g·cm-3,晶胞边长为4.28×10-10m。求
(1) FexO中x值(精确至0.01)为多少?
(2) 晶体中的Fe分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小数表示,精确到0.001)为多少?
(3) 在完整晶体中,与O2-等距且最近的6个Fe占据空隙的几何形状是?
(4) 在晶体中,铁元素的离子间最短距离为多少米?
27.(9分)二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45s时,达到平衡(NO2浓度约为 0.012 5mo1·L-1)。下图中的曲线表示二氧化氮分解反应在前25s内的反应进程。
(1) 请计算前20s内氧气的平均生成速率。
(2)若反应延续至70s,请在图中用实线画出25-70s的反应进程曲线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加催化剂后的反应进程曲线。
(4)写出该反应的化学平衡常数表达式:
.

26.(10分)位于周期表前四周期的四种元素A、B、C、D,其核电荷数依次增大。已知A、B同周期,A、D同主族,B、C的氯化物均能在水溶液中完全电离产生相应的B2+、C3+,且B2+和C3+的核外电子总数相等。现将A、B、C、D四种元素的单质做如下实验:

试回答:
(1)B2+比C3+的离子半径 (填“大”或“小”);
(2)逐一写出向溶液丙中加入D时所发生的所有可能反应的离子方程式:
①
②
③
④
25.(9分)在如图所示的容积相同的三个容器①②③中进行如下反应:3A(g)+B(g) 2C(g),ΔH<0。
2C(g),ΔH<0。
(1)若起始温度相同,分别向三个容器中充入3molA和1molB,则达到平衡时各容器中C物质的百分含量由大到小的顺序为(填容器编号) 。
(2)若维持温度不变,起始时②中投入3molA,1molB,③中投入3molA,1molB和2molC,且保持②③起始时压强相同,则达到平衡时,两容器中B的转化率② ③(填>,<或=)。
(3)保持温度不变,起始时在②中投入3molA和1molB,在③中投入amolA和bmolB及cmolC,若达到平衡时②和③中压强恰好相同,且欲使达到平衡时两容器内C的百分含量相等,则两容器中起始投料,必须满足(用含a,b,c的关系式表示) 。


①外有隔热套 ②


③活塞可移动
(不考虑活塞和容器的摩擦系数)
24.(13分)A、B、C、D、E五种微粒,它们可能是原子或离子,并且所含的元素都在短周期。A显负价时,不能被任何氧化剂氧化;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、 C3的1/2和1/3;D的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有10个电子,E极易与C+结合成中性微粒。回答:
(1)写出五种微粒的符号:A 、B 、C 、D 、E 。
(2)C的同位素名称和符号:C1 、C2 、C3 。
(3)A与B形成的化合物中存在 键,其晶体是 晶体;C和D形成分子的电子式为 ,结构式为 ,它是
(极性或非极性)分子。
23.(10分)合成氨的反应:N2+3H2 2NH3,在一定条件下已达到平衡状态。
2NH3,在一定条件下已达到平衡状态。
(1)此时 相等, 保持不变,而 仍在进行。因此化学平衡叫 平衡。
(2)若降低温度,会使上述化学平衡向生成氨的方向移动,则正反应是 反应,生成每摩氨的反应热是46.2kJ,则该反应的热化学方程式为
(3)合成氨时,选择500℃高温的目的是
(4)若反应容器的体积不变,原反应温度不变,而将平衡体系中的混合气体的浓度增大一倍,则上述平衡向
移动,若在平衡体系中加入氦气,则上述平衡 移动。
22.(6分)下列说法中正确的是
A.只要分子之间发生碰撞,就会发生化学反应。
B.增大压强,加快反应速率的本质原因是提高了单位体积内活化分子的百分数
C.达到化学平衡时,正、逆反应都停止了,所以各组分的百分含量不再变化
D.加入合适的催化剂,正、逆反应速率会等倍数变化。
E.对于反应C(s)+H2O(g) 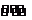 CO(g)十H2(g)(正反应吸热),达到平衡后,若升高温度,因V(正)增大, 而V(逆)减小,所以平衡向右移动
CO(g)十H2(g)(正反应吸热),达到平衡后,若升高温度,因V(正)增大, 而V(逆)减小,所以平衡向右移动
F.如果改变条件使化学平衡向右移动,生成物的产量一定增加。
G.对于反应H2(g)+I2(g) 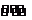 2HI(g),达到平衡后,若增大压强(缩小体积),平衡不移动,但气体的颜色会变深。
2HI(g),达到平衡后,若增大压强(缩小体积),平衡不移动,但气体的颜色会变深。
H.对于(E)中的反应,达到平衡后,再投入一定量的碳,平衡会向右移动
21.(9分)有下列八种晶体:
A.水晶 B.冰醋酸 C.氧化镁 D.白磷
E.晶体氩 F.氯化铵 G.铝 H.金刚石
(1)属于原子晶体的化合物是 ,
直接由原子构成的晶体是 ,
直接由原子构成的分子晶体是 。
(2)极性分子构成的晶体是 ,
含有共价键的离子晶体是 ,
属于分子晶体的单质是 。
(3)在一定条件下能导电而不发生化学变化的是 ,
受热熔化后化学键不发生变化的是 ,
需克服共价键的是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com