
11.从S2-+H2O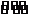 HS-+OH-水解平衡讨论,加KOH,KHS平衡逆向移动,使c(S2-)增大而c(Na+)不变;加Na2S(s)相当于减少H2O,使c(S2-)增大。加NaOH,NaHS使c(Na+)增大,不符合题意,加H2S可发生反应:Na2S+H2S=2NaHS,使c(S2-)减小,也不符合题意。
HS-+OH-水解平衡讨论,加KOH,KHS平衡逆向移动,使c(S2-)增大而c(Na+)不变;加Na2S(s)相当于减少H2O,使c(S2-)增大。加NaOH,NaHS使c(Na+)增大,不符合题意,加H2S可发生反应:Na2S+H2S=2NaHS,使c(S2-)减小,也不符合题意。
10.HA为强酸,BOH为弱碱,相互反应应生成强酸弱碱盐BA,B+能水解。
15.C 16.B 17.C 18.B 19.AD 20.D
讲析:9.对D:c(H+)甲/c(H+)乙=10-2pH/10-pH=1/10pH,即两溶液的c(H+)之比与原来乙溶液的pH有关,而不是定值。
8.电解Na2CO3溶液实质为电解水,因原溶液是饱和溶液,则因水减少有Na2CO3晶体析出,溶液浓度不变。
讲析:2.NaHSO4=Na++H++SO42- H+对水的电离产生抑制c(H+)水=c(OH-)=10-10mol•L-1;NH4Cl=NH4++Cl-,NH4+水解,对水的电离促进,c(H+)水=10-4 mol•L-1,a/b=10-10 mol•L-1/10-4 mol•L-1=10-6。
3.水电离的c(H+)=10-5 mol•L-1>10-7 mol•L-1,水的电离被促进,加入的是NH4Cl。 4.CH3COONa+H2O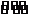 CH3COOH+NaOH加水稀释水解平衡正向移动,因溶液体积增大,有关微粒浓度降低,但当c(OH-)减小时c(H+)增大;因n(CH3COO-)减小,n(CH3COOH)增大,则c(CH3COOH)/c(CH3COO-)增大。 6.因pH=9,则c(OH-)=10-5 mol•L-1,c(Ba2+)=
CH3COOH+NaOH加水稀释水解平衡正向移动,因溶液体积增大,有关微粒浓度降低,但当c(OH-)减小时c(H+)增大;因n(CH3COO-)减小,n(CH3COOH)增大,则c(CH3COOH)/c(CH3COO-)增大。 6.因pH=9,则c(OH-)=10-5 mol•L-1,c(Ba2+)=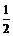 ×10-5 mol•L-1.稀释500倍后,c(Ba2+)=
×10-5 mol•L-1.稀释500倍后,c(Ba2+)=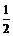 ×10-5 mol•L-1/500=10-8 mol•L-1,c(OH-)=10-5 mol•L-1/500=2×10-8 mol•L-1<10-7 mol•L-1,此时不可忽略水的电离,溶液中c(OH-)≈10-7 mol•L-1,c(Ba2+)/c(OH-)=1/10。
×10-5 mol•L-1/500=10-8 mol•L-1,c(OH-)=10-5 mol•L-1/500=2×10-8 mol•L-1<10-7 mol•L-1,此时不可忽略水的电离,溶液中c(OH-)≈10-7 mol•L-1,c(Ba2+)/c(OH-)=1/10。
30.(12分)滴定度是指每毫升标准溶液相当于被测试物质的克数,通常用T[M1/M2]表示。 如T[H2SO4/NaOH]=0.04g•mL-1,表示每毫升标准硫酸溶液恰好中和0.04gNaOH。
(1)若要使某标准盐酸对CaO的滴定度T[HCl/CaO]=0.0056g·mL-1,则该盐酸的物质的量浓度是多少?
(2)上述盐酸对NaOH的滴定度是多少?
(3)若1g含杂质的NaOH样品完全反应,消耗上述盐酸amL(杂质不与盐酸反应),则该样品的纯度是多少?
(4)若达到滴定终点时消耗bmL上述盐酸,且NaOH样品的纯度恰好为b%,则样品的质量应取多少?
29.(7分)有pH为13的氢氧化钡与氢氧化钠的混合液100mL,取出25mL用0.05mol·L-1的H2SO4滴定,当滴定至沉淀不再增加时,所消耗酸的体积是滴定至终点所消耗酸的体积的一半。试求:
(1)原混合液中氢氧化钡与氢氧化钠的物质的量浓度。
(2)当滴定至沉淀不再增加时,溶液的pH(设体积可以加和)
28.(10分)现在工业上主要采用离子交换膜法电解饱和食盐水制取H2、C12、NaOH。请回答下列问题:
(1)在电解过程中,与电源正极相连的电极上所发生的
电极反应式为 。
(2)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:
a。Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸
其合理的加入顺序为 (填试剂序号)。
(3)如果在容积为10L的离子交换膜电解槽中,1min在阴极可产生11.2L。(标准状况)H2, 这时溶液的pH
是(设体积维持不变) 。
(4)C12常用于自来水的杀菌消毒,现在有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl-,消毒等量的自来水,所需C12和ClO2的物质的量之比为 。
27.(4分)某金属的氯化物MClx18.3g溶于水制成0.1mol•L-1的溶液1L,与盛有AgNO3的电解池串联后电解,当有AgNO3的溶液电解池的阴极增重0.054g时,有MClx溶液的电解池阴极增重0.028g,则此金属的相
对原子质量 。
26.(10分)电解1 L1 mol•L-1的CuSO4溶液(惰性电极),当电路中通过0.5 mol电子时,溶液中Cu2+的浓度
为 ,H+的浓度为 。然后将电源反接,又通过1mol电子后,溶液中的Cu2+浓度
为 ,
H+的浓度为 ,
SO42-离子的浓度为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com