
28.(1)2Cl――2e-=Cl2↑ (2)bac (3)13 (4)5:2
讲析:26.由电解反应方程式

2CuSO4+2H2O 2Cu+O2↑+2H2SO4可知,当通过电子为0.5mol时,反应的Cu2+为0.25mol,生成的H+为0.5mol。当将电源反接时,阳极的0.25molCu首先溶解,然后4OH--4e-=2H2O+O2↑。
溶液中可得H+0.5mol,而阴极析出Cu2+为0.5mol,此时n(H+)总=1mol,n(Cu2+)总=0.5mol,c(Cu2+)=0.5 mol•L-1,c(H+)=1 mol•L-1。
27.112
负极反应:Cu-2e-=Cu2+
正极反应:2Fe3++2e-=2Fe2+
26.0.75 mol•L-1、0.5 mol•L-1;0.5 mol•L-1,
1 mol•L-1,1 mol•L-1
24.(1)10-14、10-12 (2)2:9 (3)4×10-3
讲析:24.(2)因100℃时,KW=10-12,pH=7时,[OH-]=10-5溶液呈碱性。
由10-4•V1-10-5•V2=10-5(V1+V2)得V1:V2=2:9
(3)c[Ca(OH)2]=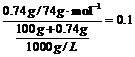 mol•L-1
mol•L-1
c(Ca2+)=0.1 mol•L-1 c(OH-)=0.2 mol•L-1
离子积为:[Ca2+]•[OH-]2=4×10-3.
23.溶液红色逐渐褪去,产生白色沉淀。
在纯碱溶液中,CO32-水解:
CO32-+H2O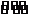 HCO3-+OH-,使溶液呈碱性,滴入酚酞溶液变红;加入BaCl2后:Ba2++CO32-=BaCO3↓(白色),由于c(CO32-)减小,CO32-水解平衡左移,c(OH-)减小,酚酞褪色。
HCO3-+OH-,使溶液呈碱性,滴入酚酞溶液变红;加入BaCl2后:Ba2++CO32-=BaCO3↓(白色),由于c(CO32-)减小,CO32-水解平衡左移,c(OH-)减小,酚酞褪色。
(2)Al3++3HCO3-=Al(OH)3↓+3CO2↑
(3)CO32-+H2O HCO3-+OH-
HCO3-+OH-
NH4++OH-=NH3↑+H2O
22.甲同学,依据电荷守恒:c(H+)+c(M+)=c(OH-)+c(A-),因c(H+)=c(OH-),则c(M+)=c(A-)。
17.由两电极 反应式相加可得总反应:CH4+2OH-+2O2=CO32-+3H2O因此反应中消耗OH-。
16.④电解后溶液呈碱性,③为电镀池,ZnCl2溶液浓度不变,①为电解CuSO4溶液,生成H+为0.002mol,c(H+)=0.002mol/0.1L=0.02 mol•L-1,②n(H+)总=0.2L×0.01 mol•L-1×2=0.004mol,反应掉的H+为0.002 mol,发生原电池反应后的c(H+)=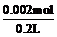 =0.01 mol•L-1.
=0.01 mol•L-1.
15.AlCl3溶液中Al3+部分水解
Al3++3H2O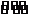 Al(OH)3+3H+,使阳离子总数有所增加。
Al(OH)3+3H+,使阳离子总数有所增加。
13.只要使溶液中c(H+)降低而不影响H+总量就符合题意,加KCl溶液使溶液体积增大,c(H+)降低;加NaF固体生成HF使c(H+)降低、但HF又可逐渐电离产生H+而不影响H+总量。加KNO3后溶液中有HNO3,反应不能得到H2;加Na2CO3将与H+发生反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com