
10.(本题12分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5mol/L,含FeCl2 3.0mol/L,含FeCl3 1.0mol/L,含HCl 3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:



 回答下列问题:
回答下列问题:
 ⑴ 上述方法获得的铜粉中含有杂质,除杂所需试剂是
(填化学式)。
⑴ 上述方法获得的铜粉中含有杂质,除杂所需试剂是
(填化学式)。
 ⑵ 实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为
。
⑵ 实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为
。
 ⑶ 下图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。
⑶ 下图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。


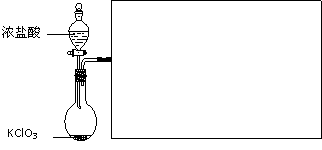



 从下图挑选所需的仪器,完成上述装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明容器中所装试剂。
从下图挑选所需的仪器,完成上述装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明容器中所装试剂。



 ⑷ 实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是:
。
⑷ 实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是:
。
 ⑸ 按上述流程操作,需称取Fe粉的质量应不少于
g(精确到0.1g),需通入Cl2的物质的量不少于 mol,加入烧瓶中的KClO3的质量应不少于 g(精确到0.1g)。
⑸ 按上述流程操作,需称取Fe粉的质量应不少于
g(精确到0.1g),需通入Cl2的物质的量不少于 mol,加入烧瓶中的KClO3的质量应不少于 g(精确到0.1g)。
9. (16分)
I、(1) 2:1 (3分) (2) 0.72 (3分)
II、 (1) < 变小 (2) 增大 不变 变小 (各2分)
9.(16分)I、合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3
(1)某FeO、Fe2O3混合物中,铁、氧原子的物质的量之比为4:5,则混合物中FeO与Fe2O3物质的量之比为___________。
(2)当催化剂中FeO与Fe2O3的物质的量之比为1:1时,其催化活性最高,此时铁的氧化物混合物中铁元素的质量分数为_____________。

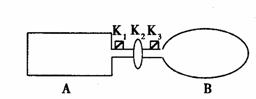 II、如图A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。
II、如图A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。
已知:2NO2(红棕色)  N2O4(无色)
△H<0
N2O4(无色)
△H<0
 (1)一段时间后反应达到平衡,此时A、B中生成的N2O4的速率是VA______VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将__________(填:变大、变小、不变)。
(1)一段时间后反应达到平衡,此时A、B中生成的N2O4的速率是VA______VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将__________(填:变大、变小、不变)。
(2)将(1)中开启的K2关闭,再向A、B中分别再充入与初始量相等的NO2,则达到新平衡时,A中NO2的转化率将 (填:增大、减小、不变);若通入的是等量的Ne气,则达到新平衡时A中NO2的转化率将 _(填:增大、减小、不变),B中NO2的转化率将 (填:增大、减小、不变)。
8.(离子方程式及化学方程式各2分,其余每空各1分,共11分)

(1)氢元素、氧元素 (2)三角锥型,极性
(3)HNO3、HNO2、NH4NO3(任写两种即可)
|
(4)NH4++OH-====NH3↑+H2O[或NH3+H3O+====NH4++H2O或OH-+H3O+===2H2O]
|
(5)3SiH4+4NH3====Si3N4+12H2
8.(11分)已知X、Y、Z、W都是短周期的非金属元素,其原子序数依次增大。W原子的质子数是Y原子质子数的两倍,X原子与W原子的最外层电子数之和是Y和Z原子的质子数之和的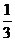 。Y的氢化物分子中有三个共价键。
。Y的氢化物分子中有三个共价键。
(1)X、Z的元素名称分别是 、 ,W元素院子结构示意图为 。
(2)Y的氢化物分子的空间构型为 ,属于 分子(填“极性”或“非极性”)
(3)由以上任意三种元素组成的化合物中,其水溶液显酸性的有(填写化学式) 、
。(任写两种)
(4)写出一个离子反应方程式,要求反应物与生成物的离子或分子均是由以上元素中的
两种元素组成且各微粒所含的电子数相同。 。
(5)我国材料学家已成功制备了W元素与Y元素组成的耐高温的新型材料W3Y4。工业
上可用W的氢化物与Y的氢化物反应制得耐高温化合物和氢气,此反应的化学方
程式为 。
7.常浊下,0.1mol·L-1某一元酸(HA)溶液中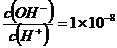 ,下列叙述正确的是( D
)
,下列叙述正确的是( D
)
A.该溶液中水电离出的c(H+)=1×10-10mol·L-1
B.该溶液中c(H+)+c(A-)+c(HA)=0.1 mol·L-1
C.该溶液与0.05 mol·L-1NaOH溶液等体积混合后:c(A-)>c(Na+)>c(OH-)>c(H+)
D.向该溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
6.合成氨反应N2+3H2 2NH3:
2NH3: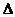 H< 0在恒容密闭的容器中反应达到平衡时,下列
H< 0在恒容密闭的容器中反应达到平衡时,下列
 说法正确的是 (
B )
说法正确的是 (
B )
A.通入稀有气体使压强增大,平衡将正向移动。
B.正、逆反应速率关系是3V正(NH3)====2V逆(H2)
C.加入铁触媒可以提高N2、H2的利用率。
D.升高温度和增大压强都有利于反应向正方向进行。
5. 以酚酞试剂为指示剂,对某新制的NaOH溶液进行中和滴定实验,数据记录入下表:
以酚酞试剂为指示剂,对某新制的NaOH溶液进行中和滴定实验,数据记录入下表:
|
|
待测液 |
消耗标准盐酸(0.1mol/L)的体积 |
|
① |
20.00mLNaOH溶液 |
V1
mL |
|
② |
20.00mLNaOH溶液+10.00mL水 |
V2
mL |
|
③ |
敞口隔夜放置的20.00mLNaOH溶液 |
V3
mL |
该新制的NaOH溶液的浓度C合理的是( B )

 A.
A.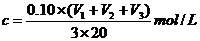 B.
B. 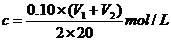

 C.
C.
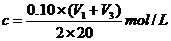 D.
D. 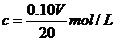
4.X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。下列说法正确的是( B )
 A.Y、Z和W三种元素位于同一周期
A.Y、Z和W三种元素位于同一周期
 B.Y元素形成的氢化物溶于水呈碱性
B.Y元素形成的氢化物溶于水呈碱性
 C.X、Y、Z和W可组成一化合物,其原子个数之比为8:2:3:1
C.X、Y、Z和W可组成一化合物,其原子个数之比为8:2:3:1
 D.Y和W两种元素位于同一主族
D.Y和W两种元素位于同一主族
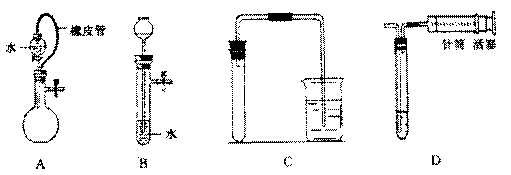
3.对下列装置.不添加其他仪器无法检查气密性的是A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com