
371.C硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
① 将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
② 向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③ 趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④ 待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤ 将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
⑴ 实验步骤①的目的是____________________,加热的作用是__________________。
⑵ 实验步骤②明显不合理,理由是__________________________________________。
⑶ 实验步骤④中用少量冰水洗涤晶体,其目的是______________;______________。
⑷ 经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O、和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在57.6℃、64℃温度下可同时析出两种晶体)。
硫酸亚铁的溶解度和析出晶体的组成
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27 |
||
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
|||||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
⑸ 若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为________。
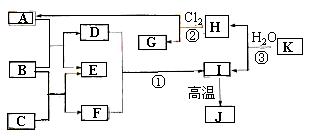
370. B下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
请按要求回答:
⑴ 写出B的化学式_______________,G的电子式_________________。
⑵ 反应①的离子方程式为_______________________________________。
⑶ 反应②进行的条件是___________________,_____________________。
⑷ 反应③的化学方程式为________________________________________。
369. B 某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是 。
(2)装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作 。
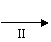
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
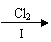
滤液 FeCl3溶液 FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
368. B 现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH
已知:CO2+3H2O+2AlO2-===2Al(OH)3↓+CO32-
(1)这五种溶液的pH由小到大的顺序是 (填编号)
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是 (填编号)
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是 (填编号)
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式 。
.
367. B 现有S2-、NH4+、Al3+、Na+、SO42-、AlO2-、Fe3+、HCO3-、Cl-等离子,请按要求填空:
(1)在水溶液中,该离子水解呈碱性的是______________________________。
(2)在水溶液中,该离子水解呈酸性的是_____________________________。
(3)既能在酸性较强溶液里、又能在碱性较强的溶液里大量存在的离子有_____________。
(4)既不能在酸性较强溶液里、又不能在碱性较强的溶液里大量存在的离子有_________。
366. B 某无色透明浓溶液,跟金属铝反应放出H2,试判断下列离子:Mg2+、Cu2+、Ba2+ 、
H+、Ag+、SO42-、SO32-、HCO3-、OH-、NO3-中,何者能存在于此溶液中:
(1)当生成Al3+时,可存在
(2)当生成AlO2-时,可存在
365. B焙模精密铸造工业常将水玻璃与石英粉混合搅拌成模壳涂料,撒碾,浸泡在氯化铵溶液中使之硬化定型,请用离子方程式表示其硬化成型原理。现有些工厂将NH4Cl溶液改为MgCl2溶液,这是为什么?
364. B BiCl3水解生成BiOCl沉淀.
(1)写出水解反应的离子方程式_______________________
(2)医药上把BiOCl叫作次氯酸铋,该名称________(填“合理”或“不合理”),其理由
是___________________.
(3)配制BiCl3溶液时,其方法是__________________________.
(4)把适量固体BiCl3置于浓NaCl溶液可得到澄清溶液,其原因是__________________.
363. B在6份0.01mol/L氨水中分别加入下列各物质:
A.浓氨水 B.纯水 C.少量K2CO3
D.少量浓H2SO4 E.少量NaOH固体 F.少量Al2(SO4)3固体
(1)能使c(OH-)减小、c(NH4+)增大的是_____________
(2)能使(OH-)增大、c(NH4+)减小的是_____________
(3)能使c(OH-)和c(NH4+)都增大的是_______________
(4)能使c(OH-)和c(NH4+)都减小的是_______________
362.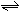 A FeCl3水解离子方程式如下:Fe3++3H2O Fe(OH)3+3H+
A FeCl3水解离子方程式如下:Fe3++3H2O Fe(OH)3+3H+ 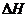 >0,请填写下表不同条件下对FeCl3水解平衡的影响:
>0,请填写下表不同条件下对FeCl3水解平衡的影响:
|
条 件 |
移动方向 |
H+数 |
PH |
Fe3+ 水解度 |
现 象 |
|
|
升温 |
|
|
|
|
|
|
|
通HCl |
|
|
|
|
|
|
|
加水 |
|
|
|
|
|
|
|
加Fe粉 |
|
|
|
|
|
|
|
加NaHCO3 |
|
|
|
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com