
9.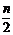
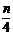
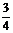 mg铁粉和含ngHNO3,的硝酸溶液恰好完全反应,若m:n=1:3,则起氧化剂作用的HN03的质量为( )
mg铁粉和含ngHNO3,的硝酸溶液恰好完全反应,若m:n=1:3,则起氧化剂作用的HN03的质量为( )
A.mg B. mg C. g D. g
8.工业废气中氮的氧化物是重要的污染源,有一种治理污染的方法是通入适量氨气将其还原为无毒物质N2和H20,现有含氮氧化物NO和NO2的混合气体3L,用同条件下的NH33.50L恰好反应完全,则混合气体中NO和NO2的体积分数比为 ( )
A.1:4 B.1:3 C.1:2 D.1:l
7.向Fe2O3和Fe粉组成的混合物中,加入适量的稀硫酸,各物质恰好完全反应。测得所得溶液中不含Fe3+,且Fe2+与H2的物质的量之比为4:1,那么在反应前Fe2O3、Fe和H2S04之间物质的量之比为 ( )
A.1:l:l B.1:2:3 C.1:2:4 D.2:3:5
6.沼气是一种能源,它的主要成分是CH4。0.5mol CH4完全燃烧生成C02和H20时,放出445kJ热量,则下列热化学方程式中正确的是 ( )
A.2CH4(g)+4O2(g)═2CO2(g)+4H20(1)
△H=+890kJ·mol-1
B.CH4 (g)+202(g)═C02(g)+2H20(1)
△H=+890kJ·mol-1
C.CH4(g)+202(g)═CO2(g)+2H20(1)
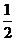
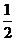 △H=一890kJ·mol-1
△H=一890kJ·mol-1
D. CH4(g)+02(g)═ C02(g)+H2O(1)
△H= - 890kJ·mol-1
5.将20mL氯气和氨气的混合气体在一定条件下充分反应,化学方程式为:3C12+8NH3=6NH4 Cl+N2已知参加反应的氯气比氨气少5mL(同温同压下),则原混合气体中氯气和氨气的物质的量之比是 ( )
A.3:2 B.2:3 C.3:8 D.3:17
4.等物质的量的Na2CO3·mH2O和BaCl2·nH20的混合物3.68g,加足量水搅拌,充分反应后可得到1.97g沉淀,则m和n值分别是 ( )
A.1和2 B.1和3 C.7和3 D.10和2
3.甲、乙两烧杯中各盛有100mL 3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=l:2,则加入铝粉的质量为 ( )
A.5.4g B.3.6g C.2.7g D.1.8g
2.常温下,在密闭容器里充入两种气体各O.1mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始的 1/4 则原混合气体可能是 ( )
A.H2和O2 B.HCl和NH3 C.H2和Cl2 D.CO和O2
1.将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比是 ( )
A.2:3 B.3:2 C.1:2 D.1:l
1. (广东省六校2009届高三第二次联考试卷)(8分)已知当溶液的pH在10左右时,铝元素主要以Al(OH)3形式存在。如果饮用水中含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(Ⅱ),使其失去携氧功能;NO3-还能被水中还原性物质还原成具有强烈致癌作用的NO2-。为此世界卫生组织规定饮用水中NO3-含量(以N计)必须小于10mg/L。为了降低饮用水中NO3-的浓度,某研究人员提出以下3种方案:
a、微碱性条件下用Fe2+还原,还原产物为NH3。
b、pH=10.25时,用铝粉还原,NO3-的还原产物主要为N2。
c、在催化剂作用下用氢气还原,还原产物主要为N2。
(1)请写出a方案的相关反应的离子方程式: 。
(2)b方案中最好用 调节pH 。
A.NaOH B.CaO C.NH3·H2O
理由是 。
(3)与a、b方案相比,c方案的优点是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com