
2.用含硫量较高的生铁来炼钢时,应采取的措施是( )
A.加入较多的硅铁 B.加入较多的焦炭
C.使用较多的生石灰 D.掺入含磷较高的废铜
1.在铁粉中加入稀HNO3,当反应完全后,尚残留少量铁粉,则溶液中含量较大的阳离子是
A.Fe2+ B . Fe3+ C.H+和Fe2+ D.Fe2+和Fe3+
3.孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3·yCu(OH)2(x、y为正整数且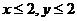 )
)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4∶1;石青则为3∶1。请推算它们的化学组成。
孔雀石∶ ;石青: 。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO23.36L(标准状况下);加热另一份样品使其完全分解,得到CuO 20g,试通过计算确定该混合物中孔雀石和石青的物质的量之比。
思维方法: 。
展望高考:
[针对训练]
A . 基础训练
2.海水的综合利用可以制备金属镁,其流程如下图所示:
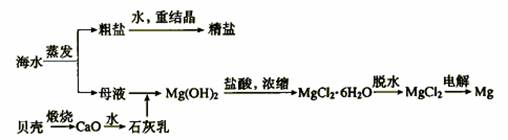
(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式。
用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时: 。过滤时: 。蒸发时: 。
思维方法: 。
展望高考:
1.铁是自然界分布最广的金属元素之一,在地壳中的质量约占5%左右。铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是Fe2O3)等。
(1)写出赤铁矿炼铁的主要化学方程式: ;
(2)红热的铁能跟水蒸气反应,有一种产物是可燃性气体,则其反应式为: ;
在常温下,铁跟水不起反应。但是,在水和空气里的氧气及二氧化碳等的共同作用下,铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。刷油漆是重要的防腐蚀措施之一,油漆防腐蚀的主要原理是 。
(3)铁元素是人体的重要营养元素,举一例说明铁元素在人体中的重要作用: 。
思维方法: 。
展望高考:
2.金属冶炼的常见方法
(1) 热分解法:
请写出中学化学中常见的用此法制取某些金属的化学方程式

(2) 热还原法:
对于多数金属的冶炼,常用的还原剂如焦碳、一氧化碳、氢气和活泼金属加热反应的方法。如:
Fe2O3 + C =
CuO + CO =
WO3 + H2 =
MnO2 + Al =
(3) 电解法:
在金属活动顺序表中, 等金属的还原性很强,这些金属都很容易失电子,因此不能用一般的方法和还原剂使其从化合物中还原出来,只能用电解其 和 的方法来冶炼.如(请用相关的化学方程式举例:说明)
[例题解析]
[例1] Fe是地壳中含量很丰富的元素,也是生物体所必需的元素。
(1)自然界中铁矿石主要有赤铁矿和磁铁矿,金属铁是在高炉中冶炼的,高炉炼铁除了加入铁矿石外,还需加入焦炭和石灰石。请填空:
①写出磁铁矿主要成分的化学式: 。
②写出赤铁矿被还原成铁的化学方程式: 。
③写出焦炭在高炉中参与反应的两个化学方程式: 。
④写出CaCO3所参与反应的两个化学方程式: 。
解题思路: 。
易错点: 。
[例2]已知Fe2O3在高炉中有下列反应
Fe2O3+CO→2FeO+CO2
反应形成的固体混和物(Fe2O3、FeO)中,元素铁和氧的质量比用mFe︰mO表示。
(1)上述固体混和物中,mFe︰mO不可能是 (选填 a、b、c多选扣分)
A.21︰9 B.21︰7.5 C. 21︰6
(2)若mFe︰mO=21︰8,计算Fe2O3被CO还原的百分率
(3)设 Fe2O3被CO还原的百分率为A%,则A%和混和物中mFe︰mO的关系式为(用含mFe、mO的代数式表示)。
A%=
请在下图中画出A%和mFe/mO关系的图形。
(4)如果 Fe2O3和CO的反应分两步进行:
3Fe2O3+CO→2Fe3O4+CO2
Fe3O4+CO→3FeO+CO2
试分析反应形成的固体混和物可能的组成及相应的mFe︰mO(令mFe︰mO=21︰a,写出a的取值范围)。将结果填入下表。
|
混和物组成(用化学式表示) |
a的取值范围 |
|
|
|
解题思路: 。
易错点: 。
[考题再现]
1.金属在自然界存在有 态也有 态,
(1) 你能否给金属的冶炼下一个定义?
(2) 金属冶炼的原理是什么?
(3) 金属冶炼一般要经过那几个步骤?
(4) 金属冶炼有哪些方法?金属活动顺序与金属冶炼方法有没有联
系呢?如果有,有什么规律吗?
金属冶炼的一般规律:
K Ca Na Mg Al
( )法
Zn Fe Sn Pb (H) Cu
( )法
Hg Ag Pt Au
( )法 ( )法
(5)在热还原法中还原剂通常是与金属氧化物反应,如果矿石不是氧化物而
是硫化物或碳酸盐时,怎么办?
(6)焦炭和氢气作为还原剂有什么区别(优缺点),如果要冶炼纯度很高的
金属一般要选用什么还原剂?用Al作为还原剂一般用于冶炼哪些金属?
3. 常识性了解金属回收与环境资源保护的意义;能写出冶炼金属方法中对应的常见金属冶炼的有关化学发方程式.
教与学方案
[自学反馈]
2.了解金属冶炼的一般原理及步骤,记住金属冶炼的三种方法,即热分解法、热还原法和电解法;
1. 常识性了解金属在自然界中的分布、存在形态以及储量;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com