
2.铵盐 由铵离子和酸根离子构成的化合物叫做铵盐。铵盐都是晶体,并且都能溶于水。
铵盐的化学性质
 (1) 铵盐受热分解 氯化铵受热时分解,生成氨气和氯化氢,冷却时氨气和氯化氢又重新结合,生成氯化铵。氯化铵有假升华现象。碳酸氢铵受热时也会分解,生成氨气、水和二氧化碳。水的状态由受热温度决定。但不是所有的铵盐受热分解都产生氨气,其它铵盐分解不作要求。
(1) 铵盐受热分解 氯化铵受热时分解,生成氨气和氯化氢,冷却时氨气和氯化氢又重新结合,生成氯化铵。氯化铵有假升华现象。碳酸氢铵受热时也会分解,生成氨气、水和二氧化碳。水的状态由受热温度决定。但不是所有的铵盐受热分解都产生氨气,其它铵盐分解不作要求。
(2) 铵盐与碱的反应 铵盐与碱共热都能产生氨气,这是铵盐的共同性质。常用此性质检验铵盐的存在,即取样品加氢氧化钠,产生的气体能使湿润的红色石蕊试纸变蓝色,说明样品含铵盐。
典型题点击
1.氨 氮气和氢气在一定条件下反应生成氨。在自然界中,氨是动物体特别是蛋白质腐败后的产物。
(1)氨的物理性质 氨是无色、有刺激性气味的气体,在标准状况下,密度是0.771g/L,比空气的小,易液化。液氨汽化时要吸收大量的热,使周围的温度急剧下降,所以液氨常做致冷剂。
(2) 氨的化学性质 氨分子呈三角锥形,是极性分子。氨分子中的氮原子有一对孤对电子。
氨气与水反应 氨气极易溶于水,通常情况下,1体积水能溶解700体积氨。氨的水溶液叫氨水。氨溶于水时,大部分氨分子和水分子形成一水合氨分子(NH3·H2O)。一水合氨分子(NH3·H2O)可以部分电离成铵根离子(NH4+)和氢氧根离子(OH-),所以氨水显碱性,使酚酞变红色。一水合氨分子(NH3·H2O)不稳定,受热时分解为氨气和水。
①氨气与氯化氢的反应 蘸浓氨水和蘸浓盐酸接近(不接触)时,产生大量白烟。氨气与氯化氢反应生成氯化铵。
②氨与氧气的反应 氨气在催化剂(如铂等)、加热的条件下,生成一氧化氮和水,并放出热量。此反应是放热反应,是工业制硝酸的基础。
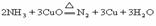 (3)氨的实验室制法 实验室里用铵盐和碱在加热条件下反应制氨气。常用熟石灰和氯化铵在加热条件下反应制氨。该反应符合强碱制弱碱的原理。属于固体加热制气体的反应,用实验室制氧气的装置。由于氨水受热分解可产生氨气,在实验室有时也用加热浓氨水的方法制氨气。
(3)氨的实验室制法 实验室里用铵盐和碱在加热条件下反应制氨气。常用熟石灰和氯化铵在加热条件下反应制氨。该反应符合强碱制弱碱的原理。属于固体加热制气体的反应,用实验室制氧气的装置。由于氨水受热分解可产生氨气,在实验室有时也用加热浓氨水的方法制氨气。
14.有三种不同质量比的氧化铜与炭粉的混合物样品①、②、③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。
(1)甲取样品①强热,所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12L气体(标准状况),则样品①中氧化铜的质量为6.0g。
(2)乙取样品②a
g强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为碳,样品②中氧化铜质量为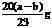 g(以含a、b的代数式表示)。
g(以含a、b的代数式表示)。
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了c g,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为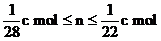 。
。
13.0.03mol Cu完全溶于一定浓度的硝酸溶液中,产生NO、NO2和N2O4共0.05mol,则混合气体的平均相对分子量范围是 44.4<M<55.2。
12.铜是生命必要的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。在化学反应中,铜元素可表现为0、+1、+2。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜(即:曾青(CuSO4)跟铁反应生成铜),
试写出该反应的离子方程式:Fe+Cu2+=Fe2++Cu。
(2)尽管铜比铁较为稳定,但铜器表面经常会生成铜锈 [即:铜绿,化学式Cu2(OH)2CO3], 其中生成铜绿的反应物除铜外还有O2、CO2和H2O。试写出保护铜制品的方法:
表面进行处理,达到隔绝空气的效果,如表面覆盖塑料等物质 。
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1183.4℃,铁的熔点是1534.8℃)
熔点比铁低,易冶炼;化学性质较稳定,便于长时间存放。
11.物质性质决定了物质的用途,下面列出了金属的几种性质:①导热性、②导电性、③还原性、④延展性、⑤具有金属光泽。请在下面用途后的横线上填上金属性质对应的序号。
(1)用铝定制成包装用的铝箔 ④ ;(2)用铁粉回收照相业废液中的银 ③ ;
(3)用铝制成的高压铝锅 ①;(4)电信业中大量使用的铜丝、金属电缆 ②。
10.已知胆矾溶于水使溶液温度降低,室温下将1mol无水硫酸铜制成溶液释放出热量Q1kJ·mol-1,又知胆矾分解的化学方程式为:CuSO4·5H2O△==CuSO4+5H2O△H=+Q2kJ·mol-1,则Q1,Q2的关系为( A)
A.Q1<Q2 B.Q1>Q2 C.Q1=Q2 D.无法确定
9.CuS和Cu2S都能溶于硝酸,它们高温灼烧的产物相同,以下鉴别CuS和Cu2S两种黑色粉末的方法合理的是(C )
A.将两种样品分别溶于硝酸,区别所产生的气体
B.将两种样品分别溶于硝酸,区别溶液的颜色
C.取两种同质量的样品分别在高温灼烧,区别残留固体的质量
D.取两种同质量的样品分别在高温灼烧,区别残留固体的颜色
8.在印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后下列结果不可能出现的是(B)
A.烧杯中有铜无铁 B.烧杯中有铁无铜 C.烧杯中铁铜都有 D.烧杯中铁铜都无
7.用H2、C、CO分别与等质量的氧化铜在高温下反应,使CuO中Cu全部还原出来,消耗H2、C、CO的质量比为(B)
A.1:l:1 B.1:3:14 C.1:6:14 D.2:1:2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com