
23、(12分)1919年,Langmuir提出:原子数相同、电子数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近,称为等电子原理。后来,该原理被推广使用于一些具有特殊功能的晶体的发现和人工合成等诸多领域。如:X是一种新型无机材料,它与碳化硅(SiC)结构相似、物理性质相近,符合该原理。X有如下的转变:
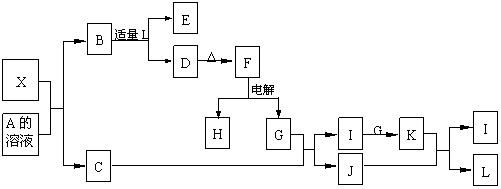
其中:C是一种能使湿润的红色石蕊试纸变蓝的无色气体,D为白色沉淀,E溶液的焰色反应中火焰呈黄色。回答以下问题:
(1)写出X的化学式:____________,X属于__________晶体(填“原子”、“分子”或“离子”)。
(2)写出X与A溶液反应的化学方程式:_____________________________________。
写出K与J反应的化学方程式:_____________________________________。
 (3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。
+2N2
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(方框中填新物质的化学式)。
+2N2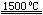 4X+SiC+3C。
4X+SiC+3C。
22、(8分)现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。人类已知的化合物中,有一类化合物的种类已超过三千万种,这类化合物中一般都含有A、B两种元素。根据以上信息回答下列有关问题:
(1)请写出下列元素的元素符号:
B________________ D______________ E_______________。
(2)写出B、D两元素组成的非极性分子的电子式_____________________。
(3)写出由上述五种元素中的四种元素组成的离子化合物的化学式(写出2种即可)
_____________________、________________________。
(4)在A、B、D三种元素中选择2种或3种元素,组成2种可发生反应的阴离子,请写出该反应的离子方程式:___________________________________________。
21、(8分)A、B、C、D、E都是元素周期表中前20号元素,原子序数依次增大,B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族,B、C、D的最高氧化物的水化物两两混合均能发生反应生成盐和水。
根据以上信息回答下列问题:
(!)A和D氢化物中,沸点较低的是 (选填“A”或“D”);A和B的离子中,半径较小的是 (填离子符号)
(2)元素C在元素周期表中的位置是 。
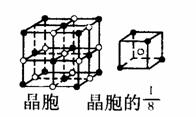
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子(用“ ”表示)位于该正方体的顶点或面心;阴离子(用“ ”表示)均位于小正方体中心。该化合物的电子式是 。


20、(14分)随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将NaCl固体细粒干燥后,准确称取m gNaCl固体细粒并转移到定容仪器A中
 ②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积V
cm3。
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积V
cm3。
(1)步骤①中仪器A最好使用 (填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
(2)步骤②中是否用酸式滴定管还是用碱式滴定 管 ,理由是
|
(3)能否用水代替苯 ,理由是
。
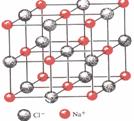
(4)已知NaCl晶体中,靠得最近的Na+、Cl-间的距离为a cm(如上图),则用上述方法测得的阿佛加德常数NA的表达式为 。
19、有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
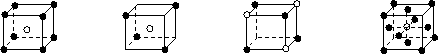
A B C D
《物质结构 元素周期律》 测试题
第II卷(共83分)
18、有Xn+、Ym+、Zn-,已知它们各自带有的电荷数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数。若按X→Y→Z的顺序,下列说法中正确的是]
A、它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强
B、它们的原子半径依次增大;
C、它们的单质在常温、常压下的密度依次减小
D、它们的最高价氧化物的水化物都是强电解质
17、某氧原子的质量为a g,12C原子的质量为b g,且NA表示阿氏常数,下列说法中正确的是:
A、氧元素的相对原子质量为12a/b B、1mol该原子质量为aNAg
C、x g该氧原子所含的电子数为8x/a D、y g 该氧原子的中子数一定为8y/a
16、短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10,A与C同主族,B原子最外层电子数等于A原子次外层电子数,则下列叙述正确的是
A、原子半径A<B<C B、A的氢化物的稳定性大于C的氢化物;
C、B的氧化物熔点比A的氧化物高; D、A与C可形成离子化合物。
15、近年来,科学家发现由100个碳原子构成的一个具有完美对称性的C100原子团,其中每个C原子仍可形成4个化学键。最内是由20个C原子构成的正十二面体,每个C原子与相邻的3个C原子相连;外层的60个C原子形成12个分立的正五边形;处于中间层的C将内外层的所有C连接在一起,当它与氢或氟在适当条件下充分反应时,其形成的分子式应为
A、C100H20和C100F20 B、C100H60和C100F60
C、C100H12和C100F12 D、C100H40和C100F40
14.最近发现一种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为( ).
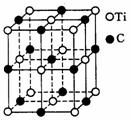
A.TiC B.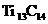 C.
C.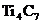 D.
D.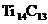
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com