
21.D22.A23.D 25D.26.D 27C 28. B. 29B30. C
11.D 12C 13 B.14C 15.A 16 D. 17.D.18.D.19. D20.B.
1.A 2. D 3.C 4.B 5.B
6.A  7.
7. C
C
 8.
8. C9.
C9. B10.D
B10.D
33.
抗击“非典”期间,过氧乙酸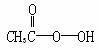 是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
 ① □MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
① □MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
 ② H2O2+2
② H2O2+2 +2H+
I2+2H2O
+2H+
I2+2H2O
 ③
③ 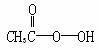 +2
+2 +2H+
CH3COOH+I2+H2O
+2H+
CH3COOH+I2+H2O
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
 □MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
□MnO4+□H2O2+□H+
□Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是____________________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·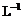 的KmnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
的KmnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·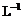 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ________________________。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是
否影响测定结果 _______________(填是或否)
32.
 烟气中NOx是NO和NO2的混合物(不含N2O4)。
烟气中NOx是NO和NO2的混合物(不含N2O4)。
 (1)根据废气排放标准,1m3烟气最高允许含400mgNOx。若NOx中NO质量分数为0.85,则1m3烟气中最高允许含NO
L(标准状况,保留2位小数)。
(1)根据废气排放标准,1m3烟气最高允许含400mgNOx。若NOx中NO质量分数为0.85,则1m3烟气中最高允许含NO
L(标准状况,保留2位小数)。
 (2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度1.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为
mol/L(保留2位小数)。
(2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度1.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为
mol/L(保留2位小数)。
 (3)已知:NO+NO2+Na2CO3=2NaNO2+CO2
①
(3)已知:NO+NO2+Na2CO3=2NaNO2+CO2
①
 2NO2+Na2CO3=NaNO2+NaNO3+CO2 ②
2NO2+Na2CO3=NaNO2+NaNO3+CO2 ②
1m3 含2000mgNOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟
含2000mgNOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟
气 排放标准(填“符合”或“不符合”),理由: 。
 (4)加入硝酸可改变烟气中NO和NO2的比,反应为:
(4)加入硝酸可改变烟气中NO和NO2的比,反应为: NO+2HNO3=3NO2+H2O
NO+2HNO3=3NO2+H2O
 当烟气中n(NO)︰n(NO2)=2︰3时,吸收率最高。
当烟气中n(NO)︰n(NO2)=2︰3时,吸收率最高。
 1m3烟气含2000mgNOx,其中n(NO)︰n(NO2)=9︰1。
1m3烟气含2000mgNOx,其中n(NO)︰n(NO2)=9︰1。
 计算:(i)为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数)。
计算:(i)为了达到最高吸收率,1m3烟气需用硝酸的物质的量(保留3位小数)。
 (ii)1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
(ii)1m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
31.实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+ [滴定时,1 mol(CH2)6N4H+与 l mol H+相当],
然后用NaOH标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500g。
步骤II 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)
③滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
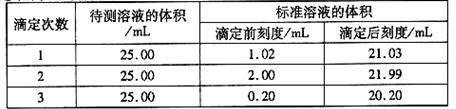
若NaOH标准溶液的浓度为0.1010mol·L-1则该样品中氮的质量分数为
30.用浓硫酸吸收SO3可得到H2SO4·SO3,若用1.00克98%的硫酸溶液充分吸收SO3后,再进行稀释,可得到98%的硫酸质量为 A.1.98g B.2.00g C.2.22g D.2.42g
29.一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000
mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
提示:①H2C2O4是二元弱酸
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.008889 B.0.08000 C.0.1200 D.0.2400
28.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物: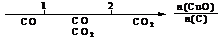
B.Fe在Cl2中的燃烧产物: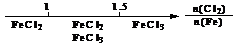
C.AlCl3溶液中滴加NaOH后铝的存在形式: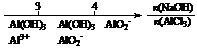
D.氨水与SO2反应后溶液中的铵盐:
27.将钠、镁、铝各0.3mol 分别放入100mL 1 mol/L 的盐酸中,同温同压下产生的气体体积比是
A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com