
1.通过对基本概念的学习,使学生对氧化还原反应的特征、实质和转换关系有正确认识;能从具体反应中识别出氧化剂、还原剂、氧化产物、还原产物;会进行多个氧化还原反应的比较或者从物质化合价来确定氧化剂、还原剂相对强弱。
10.氧化还原反应:
|
基 本 概 念 |
氧化还原反应:有电子转移的反应。(特征元素化合物有变化) 氧化反应:原子或离子失电子反应。化合介升高 还原反应:原子或离子得电子反应。化合价降低 氧化剂:得电子物质。得电子能力越强氧化性越强 还原剂:失电子物质。失电子能力越强还原性越强 |
|
转 化 关 系 |
还原性 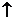 化合价升高 化合价升高还原剂  氧化反应 氧化反应 氧化产物 产物 氧化产物 产物氧化剂  还原反应 还原反应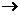 还原产物 还原产物反应物 化合价降低 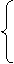 氧化性
氧化性 |
|
电子转 移表示法 |
 单箭号表示法
表示意义 单箭号表示法
表示意义二者主要区别 箭号起止 双箭号表示法 电子数目 |
|
方程式配平 |
依据原则:氧化剂化合价降低总数=还原剂化合价升高总数 方法 找出价态变化,看两剂分子式,确定升降总数 方法 找出价态变化,看两剂分子式,确定升降总数步骤 求最小公倍数,得两剂系数,观察配平其它。 |
|
有关计算 |
关键是依据氧化剂得电子总数与还原剂失电子总数相等,列出守恒关系式求解。 |
9.硝酸盐和磷酸盐性质与鉴别
|
盐类 |
硝酸盐 |
磷酸盐 |
|
颜色状态溶解性 |
一般为无(白)色晶体一般都 易溶于水 |
一般为无色晶体 磷酸=氢盐易溶于水,其它磷酸盐只K+、Na+、NH+4盐溶于水 |
|
热稳定性 |
加热时都易分解,分解规律:K+ Na+,Mg2+ Na+,Mg2+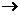 Cu2+,Ag+ Cu2+,Ag+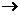 Au3+ Au3+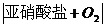 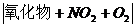 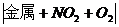 |
   热稳定性高。(磷酸盐之间相互转化)磷酸 热稳定性高。(磷酸盐之间相互转化)磷酸磷酸  氢盐 氢盐磷酸氢盐 磷酸盐 |
|
鉴别 |
硝酸盐与浓H2SO4铜片共热产生红棕色气体4NaNO3+2H2SO4(浓)+Cu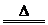 2Na2SO4+Cu(NO3)2 2Na2SO4+Cu(NO3)2+2NO2  +2H2O +2H2O |
PO3-4+3Ag+ Ag3PO4(黄) Ag3PO4(黄) 鉴别HPO2-4,H2PO-4可先加碱中和再按PO3-4鉴定 鉴别HPO2-4,H2PO-4可先加碱中和再按PO3-4鉴定 |
8.氨和铵盐的性质与制法
|
名称与符号 |
氨(NH3) |
铵(NH+4) |
|
颜色与状态 |
无以刺激性气味气体 |
白色晶体 |
|
化学键类型 |
共价键 |
共价键、离子键、配位键 |
|
晶体类型 |
分子晶体 |
离子晶体 |
|
水溶性 |
易溶于水,溶液为减性 |
均易溶于水,溶液多酸性 |
|
化学性质 |
① ①
水合反应: NH3+H2O  NH3 NH3 H2O H2O NH+4+OH- NH+4+OH-② 同O2反应:4NH3+5O2 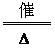 4NO+6H2O 4NO+6H2O③ 同酸反应:NH3+HNO3  NH4NO3 NH4NO3 |
① ①
同碱反应: 2NH4Cl+Ca(OH)3 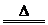 CaCl2+2NH3 CaCl2+2NH3 +2H2O;NH+4+OH- +2H2O;NH+4+OH- NH3 NH3 +H2O +H2O② ② 受热分解 2NH4NO3 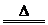 2N2 2N2 +O2 +O2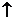 +4H2O +4H2O③水解NH+4+H2O  NH3·H2O+H+ NH3·H2O+H+ |
|
制法 |
2NH4Cl+Ca(OH)2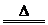 2NH3 2NH3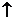 +CaCl2+2H2O +CaCl2+2H2O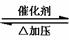 N2+3H2 2NH3 N2+3H2 2NH3
|
NH3+CO2+H2O NH4HCO3 NH4HCO32NH3+H2SO4  (NH4)2SO4 (NH4)2SO4 |
|
鉴别 |
与HX冒白烟,湿红石芯试纸变蓝 |
与碱混合加热有使石蕊试纸变蓝气体 |
|
相互关系 |
 NH3
NH+4 NH3
NH+4 |
7.硝酸与磷酸性质
|
物质 |
硝酸 |
磷酸 |
|
颜色状态 |
纯硝酸为无色易挥发液体,因溶解部分NO2呈黄色 |
纯磷酸为无色晶体,浓溶液为无色粘稠状液体(83%上) |
|
挥发性 |
易挥发,有刺激性气体 |
难挥发性酸,吸湿性强 |
|
水溶性 |
与水互溶,强酸,有酸的通性 |
与水互溶,中强酸,具有酸的通性 |
|
稳定性 |
不稳定,见光或受热分解 4HNO3 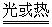 4NO2 4NO2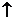 +O2 +O2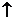 +2H2O +2H2O |
很稳定 |
|
氧化性 |
能氧化Au、Pt外所有金属和部分非金属C+4HNO3浓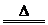 CO2 CO2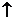 +2H2O+4NO2 +2H2O+4NO2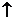 ;Cu+4HNO3浓 ;Cu+4HNO3浓 Cu(NO3)2+2NO2 Cu(NO3)2+2NO2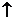 +2H2O +2H2O |
几乎无氧化性,可制HBr、HI及H2S等2NaBr+H3PO4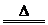 Na2HPO4+2HBr 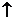 Na2S+H3PO4 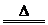 Na2HPO4+H2S Na2HPO4+H2S |
|
实验室制法 |
NaNO3+H2SO4浓 NaHSO4+HNO3 NaHSO4+HNO3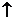 (HNO3易分解不能加热) (HNO3易分解不能加热) |
P2O5+3H2O热 2H3PO4 2H3PO4 |
|
工业制法(氨氧化法) |
4NH3+5O2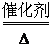 4NO+6H2O 4NO+6H2O2NO+O2  2NO2;3NO2+H2O 2NO2;3NO2+H2O 2HNO3+NO 2HNO3+NO |
Ca3(PO4)2+3H=SO4浓 3CaSO4 3CaSO4  +2H3PO4 +2H3PO4 |
|
鉴别 |
铜与浓硝酸反应产生红棕色NO2气体 |
3Ag++PO3-4 Ag3PO4 Ag3PO4 (黄色) (黄色)(先用碱中和) |
6.磷的同素异形体性质
|
异形体 |
白磷(黄磷) |
红磷(赤磷) |
|
异形体 |
白磷(黄磷) |
红磷(赤磷) |
|
组成 |
P4 |
P(结构复杂) |
键角 |
60° |
- |
|
|
色态 |
白色蜡状固体 |
红棕色固体 |
键的极性 |
非极性键 |
非极性键 |
|
|
水溶性 |
不溶于水 |
不溶于水 |
分子极性 |
非极性分子 |
非极性分子 |
|
|
CS2中溶解 |
溶解 |
不溶 |
保存 |
保存在水中 |
密封保存 |
|
|
着火点 |
40℃ |
240℃ |
相互转化 |
 白磷 白磷红磷  |
||
|
燃烧 |
空气中自然 |
不能自然 |
||||
|
构型 |
正四面体 |
复杂 |
鉴别 |
空气中自然 |
|
5.氮和磷的氢化物结构与性质
|
氢化物的名称 |
氨气 |
磷化氢 |
|
氢化物分子式 |
NH3 |
PH3 |
|
电子式 |
H 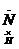  H H |
H 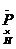  H H |
|
分子构型 |
三角锥形 |
三角锥形 |
|
键的极性 |
极性 |
极性 |
|
晶体类型 |
分子晶体 |
分子晶体 |
|
颜色和状态 |
无色刺激性气味气体 |
无色气体 |
|
毒性 |
无毒 |
剧毒 |
|
与O2反应 |
4NH3+5O2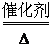 4NO+6H2O 4NO+6H2O4NH3+3O2 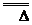 2N2+6H2O 2N2+6H2O |
2PH3+4O2 P2O5+3H2O P2O5+3H2O(空气中能自燃) |
|
与水反应 |
NH3+H2O NH3 NH3 H2O H2O NH+4+OH- |
难反应 |
|
与酸反应 |
NH3+HClNH4Cl |
PH3+HClPH4Cl |
|
制法 |
N2+3H22NH3(工业) 2NH4Cl+Ca(OH)22NH3 +CaCl2+2H2O |
P4+6H24PH3 |
4.氮和磷的氧化物性质与制法
|
氧化物 |
一氧化二氮 |
一氧化氮 |
三氧化二氮 |
二氧化氮 |
五氧化二氮 |
三氧化三磷 |
五氧化二磷 |
|
分子式 |
N2O |
NO |
N2O3 |
NO2 |
N2O5 |
P2O3 |
P2O5 |
|
颜色状态 |
无色甜味气体 |
无色气体 |
蓝色液体 |
红棕色气体 |
白色固体 |
蜡状固体 |
白色固体 |
|
与水作用 |
溶解但不反应 |
不溶于水 |
N2O3+H2O 2HNO3 2HNO3 |
3NO2+H2O 2HNO3+NO 2HNO3+NO |
P2O3+H2O 2HNO3 2HNO3 |
P2O3+3H2O 2H3PO4 2H3PO4 |
P2O5+3H2O 2H3PO4 2H3PO4 |
|
稳定性 |
不太稳定 |
易与O2反应用2NO+O2 2NO2 2NO2 |
不稳定 |
不稳定2NO2 N2O4 N2O4 |
不稳定 |
不稳定 P2O3+O2  P2O5 P2O5 |
稳定 |
|
制法 |
NH4NO3 N2O N2O +2H2O +2H2O |
3Cu+8HNO3(稀)  3Cu(NO3)2 3Cu(NO3)2+2NO  +4H2O +4H2O |
NO2+NO N2O3 |
Cu+4HNO3(浓) Cu(NO3)2 Cu(NO3)2+2NO2  +2H2O +2H2O |
2NO2+O3 N2O5+O2 |
P4+3O2 (充足)  P4O6(P2O3) |
P4+5O2(充足) P4O10(P2O5) P4O10(P2O5) |
3. 氮无限制族元素的主要性质及递变规律
氮无限制族元素的主要性质及递变规律
|
元素 |
氮 |
磷 |
砷 |
锑 |
铋 |
|
|
原子序数 |
7 |
15 |
33 |
51 |
83 |
|
|
单质色态 |
无色气体 |
白色(淡黄)固体,暗红色固体 |
灰色固体 |
银白色金属 |
银白色或微红色金属 |
|
|
熔点(℃) |
-209.86 |
44.1(白磷) |
817(2.8×106Pa) |
630.74 |
1560 |
|
|
化合价 |
-3,+1,+2,+3,+4,+5 |
-3,+3,+5 |
-3,+3,+5 |
-3,+3,+5 |
+3,+5 |
|
|
最高价氧化物及对应水化物酸性 |
N2O5 |
P2O5 |
As2O5 |
Sb2O5 |
Bi2O5 |
|
|
HNO3 |
H3PO4 |
H3AsO4 |
H3SbO4 |
H3BiO4 |
||
 非金属性逐渐减弱,金属性逐渐增强 |
||||||
|
同H2化合条件及氢化物稳定性 |
一定条件直接化合,NH3很稳定 |
很难直接化合,PH3不稳定 |
不能直接化合,AsH3受热分解 |
不能直接化合,SbH3很易分解 |
不能直接化合,BiH3常温分解 |
|
|
非金属性 |
 非金属性逐渐减弱,金属性逐渐增强 |
|||||
|
|
|
|
|
|
|
|
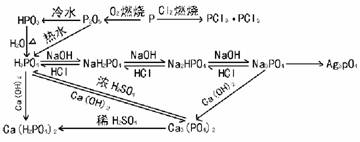
2. 磷及其重要化合物的转化关系:
磷及其重要化合物的转化关系:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com