
2.例题解析
例1.分析下列反应自发进行的温度条件。
(1)2N2(g) + O2(g) → 2 N2O(g);ΔH = 163 kJ. mol-1
(2)Ag (s) + 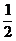 Cl2( g
) → AgCl ( s);ΔH = - 127
kJ. mol-1
Cl2( g
) → AgCl ( s);ΔH = - 127
kJ. mol-1
(3)HgO(s)→
Hg ( l ) + 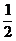 O2( g );ΔH = 91 kJ. mol-1
O2( g );ΔH = 91 kJ. mol-1
(4)H2O2( l ) →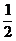 O2( g )
+ H2O( l ) ;ΔH = - 98 kJ. mol-1
O2( g )
+ H2O( l ) ;ΔH = - 98 kJ. mol-1
解析:反应自发进行的前提是反应的ΔH-TΔS<0,与温度有关,反应温度的变化可能使ΔH-TΔS符号发生变化。
(1)ΔH >0,ΔS<0,在任何温度下,ΔH-TΔS>0,反应都不能自发进行。
(2)ΔH <0,ΔS<0,在较低温度时,ΔH-TΔS<0,即反应温度不能过高。
(3)ΔH >0,ΔS>0,若使反应自发进行,即ΔH-TΔS<0,必须提高温度,即反应只有较高温度时自发进行。
(4)ΔH <0,ΔS>0,在任何温度时,ΔH-TΔS<0,即在任何温度下反应均能自发进行。
例2.通常采用的制高纯镍的方法是将粗镍在323K与CO反应,生成的Ni(CO)4经提纯后在约473K分
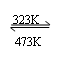
解得到高纯镍。Ni( s ) + 4CO(g) Ni(CO)4 ( l ) 已知反应的ΔH = -161 kJ. mol-1
ΔS = -420 J. mol-1. K-1。试分析该方法提纯镍的合理性。
分析:根据ΔH-TΔS = 0时,反应达到平衡,则反应的转折温度为:
T = 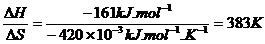
当T<383K时,ΔH-TΔS<0,反应正向自发进行;
当T>383K时,ΔH-TΔS>0,反应逆向自发进行。
粗镍在323K与CO反应能生成Ni(CO)4,Ni(CO)4为液态,很容易与反应物分离。Ni(CO)4在473K分解可得到高纯镍。因此,上述制高纯镍的方法是合理的。
基础训练
1.方法导引
(1)通过计算或分析能确定ΔH –TΔS的符号,进而确定反应自发进行的方向是本节的重点。
(2)熵是体系微观粒子混乱程度的量度。体系混乱度越大,其熵值越大。一般情况下气态物质的熵大于液态物质的熵,液态物质的熵大于固态物质的熵;相同物态的不同物质,摩尔质量越大,或结构越复杂,熵值越大。
(3)对某化学反应,其熵变ΔS为反应产物总熵与反应物总熵之差。在化学反应过程中,如果从固态物质或液态物质生成气态物质,体系的混乱度增大;如果从少数的气态物质生成多数的气态物质,体系的混乱度也变大。这时体系的熵值将增加。根据这些现象可以判断出过程的ΔS>0。
(4)利用ΔH -TΔS 的符号可判断恒温恒压条件下反应的方向:ΔH -TΔS<0时,反应自发进行;ΔH –TΔS = 0时,反应达到平衡状态;ΔH–TΔS>0反应不能自发进行。当焓变和熵变的作用相反且相差不大时,温度可能对反应的方向起决定性作用,可以估算反应发生逆转的温度(正为转向温度):T(转)=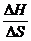 。化学反应体系的焓变减少(ΔH<0)和熵变增加(ΔS>0)都有利于反应正向进行。
。化学反应体系的焓变减少(ΔH<0)和熵变增加(ΔS>0)都有利于反应正向进行。
※(5)在一定温度范围内,反应或过程的ΔH(T)≈ΔH(298K), ΔS(T)≈ΔS(298K),式中温度T既可以是298K,也可以不是298K,这是由于当温度在一定范围改变时,反应的ΔH =ΔfH(反应产物)–ΔfH(反应物)。尽管反应物与生成物的ΔfH,S均相应改变,但它们相加减的最终结果仍基本保持不变。
5.恒压下温度对反应自发性的影响
|
种类 |
ΔH |
ΔS |
ΔH-TΔS |
反应的自发性 |
例 |
|
1 |
- |
+ |
|
|
2H2O2(g)→2H2O(g)+O2(g)
|
|
2 |
+ |
- |
|
|
2CO(g)→2C(s)+O2(g) |
|
3 |
+ |
+ |
在低温 在高温 |
|
CaCO3(s)→CaO(s)+CO2(g) |
|
4 |
- |
- |
在低温 在高温 |
|
HCl(g)+NH3(g)→NH4Cl(s) |
当ΔH,ΔS符号相同时,反应方向与温度T______(有关,无关)
当ΔH,ΔS符号相反时,反应方向与温度T______(有关,无关)
学习导航
4.在___________一定的条件下,化学反应的方向是____________共同影响的结果,反应方向的判据为_______________。
当其值:大于零时,反应________________
小于零时,反应_______________
等于零时,反应________________
即在__________一定的条件下,反应_____(放热,吸热)和熵______(增大,减小,不变)都有利于反应自发进行。
3. 熵变为___________________________,用符号_______表示。
产生气体的反应,气体的物质的量增大的反应,为熵值______(增大,减小,不变)的反应,熵变为______(正,负)值。
2. 熵,符号为____,单位______,是描述_____________的物理量,熵值越大,___________。
在同一条件下,不同的物质熵值______,同一物质S(g)___S(l) ____ S(s) (<,>,=)。
1. 焓变______(是,不是)决定反应能否自发进行的唯一因素。
2. 能用焓变和熵变说明化学反应进行的方向。
知识梳理
1. 理解熵及熵变的意义
Look at these clothes. They look very nice. Whose shoes are these? Oh, they are Michael’s. Give the yellow skirt to Jane. I think it’s his. Are the long blue pants mine? No, they are his. His name is Wang Wei. He is tall and he has long legs.
2010--2011学年度第一学期惠来县
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com