
2.A、B、C、D都是含碳、氢、氧的单官能团化合物,A水解得B和C,B氧化可以得到C或D,D氧化也得到C。若M(X)表示X的摩尔质量,则下式中正确的是 ( )
A.M(A)=M(B)+M(C) B.2M(D)=M(B)+M(C) C.M(B)<M(D)<M(C) D.M(D)<M(B)<M(C)
1.下图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X),纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃性气体,C是A和B的混合气体,则C中n(A):n(B)为 ( )
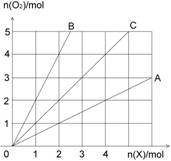 A.2:l B.1:2
C.1:1 D.任意比
A.2:l B.1:2
C.1:1 D.任意比
9、(广东漳州市芗城中学高三年10月考)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为:8CuFeS2+21O2 高温8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
 (3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-===2SO42-+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-===2SO42-+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。
、
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为
8、(广东漳州市芗城中学高三年10月考)下列有关铁及其化合物的说法中不正确的是
A.工业上在高温下用CO还原含Fe2O3的铁矿石炼铁
B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
C.工业上可用铁质容器储存、运输浓硝酸、浓硫酸
D.氯化铁溶液有较强氧化性,故可用作净水剂
7. (广东省梅州市曾宪梓中学2009届高三11月月考 )(12分)
铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室的Cu2O试样中是否含有Cu进行了认真的探究。
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;③Cu2O在酸性条件下能发生自身氧化还原反应(Cu2O+2H+=Cu+Cu2++H2O)。
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
 方案2:取该红色试样溶于足量的稀硫酸中,观察是否有残渣
方案2:取该红色试样溶于足量的稀硫酸中,观察是否有残渣
方案3:称得干燥坩埚的质量为a g ,取红色试样置于坩埚中称得总质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量。如此反复多次直到质量不变,称得最后质量为c g。分析数据,作出合理判断。
(1)请你评价方案1和方案2。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。
(2)方案3中,如果a、b、c的关系符合c= 可确认红色粉末是Cu2O
Ⅲ.研究性学习小组乙,设计了新的探究方案,装置如图所示。
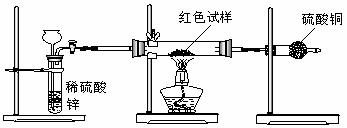
(3)简述新探究方案中,气体发生装置的气密性如何检验(操作、现象、结论):
(4)你认为依据新方案测定上述红色试样成分必须获得下列哪些物理量:(选填序号)
①通入氢气体积;②反应前,红色试样+硬质试管的总质量;③完全反应后红色固体+硬质试管的总质量;④实验前,干燥管(含药品)的质量;⑤硬质试管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管(含药品)的质量
(5)有人提出,在氢气发生器与硬质试管之间应加一个干燥装置,你认为 (选填“需要”或“不需要”),简述理由
答案(1)方案Ⅰ不合理,铜和氧化亚铜都能和硝酸生成Cu2+;方案Ⅱ不合理,Cu+在酸性条件下能发生自身氧化还原反应,也生成了铜单质。 (3分)
(2)c= (10b-a) (2分)
(3)关闭活塞,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置的漏气 (2分)
(4)②③⑤ (2分)
(5)需要 (1分);
反应后,应让铜粉在氢气流中冷却,如没有干燥管,铜粉将吸湿。(2分)
6.(广东省佛山市禅城实验高中2009届高三第二次月考)某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:

方案I:铜铝混合物 测定生成气体的体积

方案II:铜铝混合物 测定剩余固体的质量
下列有关判断中不正确的是:( ) ( ( B)
A. 溶液A和B均可以是盐酸或NaOH溶液 B. 溶液A和B均可以选用稀硝酸
C. 若溶液B选用浓硝酸,则测得铜的质量分数偏小 D. 实验室方案II更便于实施
5.(广东省佛山市禅城实验高中2009届高三第二次月考) 2006年11月23日中科院网报道,核磁共振造影增强剂用于疾病的诊断,还可以作为药物载体用于疾病的治疗。中科院化学研究所在肿瘤鉴别诊断用磁共振造影剂研究方面取得重要进展。为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景。制备纳米四氧化三铁过程如下:
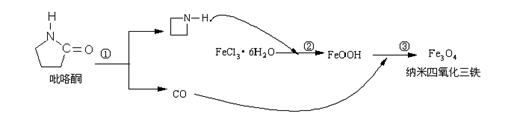
下列有关叙述不合理的是(B ):
A.纳米四氧化三铁具有磁性作为药物载体用于疾病的治疗
B.纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当
C.在反应②环丙胺的作用可能是促进氯化铁水解
D.反应③的化学方程式是:6FeOOH +CO = 2Fe3O4 +3H2O + CO2
4. (广东省佛山市禅城实验高中2009届高三第二次月考)(13分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略
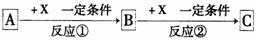 去)。
去)。
试回答:
(1)若X的强氧化性单质,则A不可能是 。(填选项)
a. S b. N2 c. Na d. Mg e. Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示) ,检验此C溶液中金属元素价态的操作方法是 。
(3)若A、B、C为含有金属元素的化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式可能为 ,X的化学式可能为(写出不同类物质)
或 ,反应①的离子方程式为
或 。
答案(1)d e(2分)
(2)FeCl3(1分);2Fe3++Fe 3Fe2+(1分),防止Fe2+被氧化(1分)
 用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe2+存在。(2分)(答出要点可得分,其他正确答案参照本标准给分)。
用试管取少量C溶液,滴加KSCN溶液,无颜色变化,再滴加氯水(或硝酸),溶液呈红色,证明原溶液中有Fe2+存在。(2分)(答出要点可得分,其他正确答案参照本标准给分)。
(3)Al(OH)3(1分);NaOH(或KOH)(1分);HCl(或其他强酸)(1分)
Al3++3OH- Al(OH)3↓(1分);AlO2-+H++H2O Al(OH)3↓(2分)
3.(广东省汕头金山中学2009届高三化学期中考试)制印刷电路时常用氯化铁作腐蚀液,有关反应为2FeCl3 + Cu =2FeCl2 + CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯中不可能出现的是( B)
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
2、(广东省中山一中2009届高三第二次统测化学试题)(10分)
某同学利用铁与水蒸气反应后的固体物质进行了如下实验:

(1)固体溶于稀盐酸的化学方程式为 。
(2)试剂1的化学式是 。
(3)加入新制氯水后溶液红色加深的原因是(用离子方程式表示)
;
(4)某同学在实验中加入了过量氯水,放置一段时间后,发现深红色褪去,现对褪色原因进行探究。
①提出假设:
假设1:溶液中的+3价铁被氧化为更高的价态;
假设2: ;
②设计方案:
为了对你所提出的假设2进行验证,实验方案是
答案(1) Fe3O4 + 8HCl==2FeCl3+FeCl2+4H2O(2分)
(2)KSCN(2分)
(3)2Fe2++Cl2=2Fe3++2Cl- (2分)
(4)①假设2:SCN-被过量的氯水氧化(2分)
②取少量褪色后的溶液,滴加过量KSCN溶液,如果出现红色,则说明假设2 正确,若不变红,则假设2不正确。(2分)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com