
21. (10分)甲、乙是两种常见短周期元素的单质,其有关化合物的性质如图所示,其中C为白色沉淀,D为气体.
(10分)甲、乙是两种常见短周期元素的单质,其有关化合物的性质如图所示,其中C为白色沉淀,D为气体.

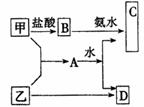
 (1)若D为酸性气体,则元素符号:甲_______________乙_______________;
(1)若D为酸性气体,则元素符号:甲_______________乙_______________;
 A与水反应的化学方程式为____________________________________________.
A与水反应的化学方程式为____________________________________________.
 (2)若D为碱性气体,则元素名称:甲_______________乙_______________;
(2)若D为碱性气体,则元素名称:甲_______________乙_______________;
 A与水反应的化学方程式为____________________________________________.
A与水反应的化学方程式为____________________________________________.
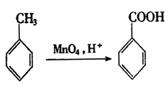
 22.(10分)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基,例如
22.(10分)烷基苯在高锰酸钾的作用下,侧链被氧化成羧基,例如

 化合物A-E的转化关系如图1所示,已知:A是芳香化合物,只能生成3种一溴化合物,B有酸性,C是常用增塑剂,D是有机合成的重要中间体和和常用化学试剂(D也可由其他原料催化氧化得到),E是一种常用的指示剂酚酞,结构如图2.
化合物A-E的转化关系如图1所示,已知:A是芳香化合物,只能生成3种一溴化合物,B有酸性,C是常用增塑剂,D是有机合成的重要中间体和和常用化学试剂(D也可由其他原料催化氧化得到),E是一种常用的指示剂酚酞,结构如图2.

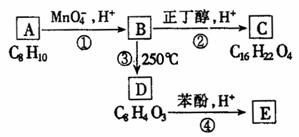
 图1
图1

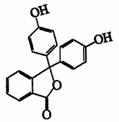
 图2
图2
 写出A、B、C、D的结构简式:
写出A、B、C、D的结构简式:
 (1)A:____________________________________________.
(1)A:____________________________________________.
 (2)B:____________________________________________.
(2)B:____________________________________________.
 (3)C:____________________________________________.
(3)C:____________________________________________.
 (4)D:____________________________________________.
(4)D:____________________________________________.





 21世纪教育网
21世纪教育网






















19. (10分) 木浆纤维在离子液体中的溶解性
(10分) 木浆纤维在离子液体中的溶解性
|
离子液体 |
溶解条件 |
溶解度(质量%) |
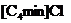 |
加热到100℃ |
10% |
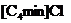 |
微波加热 |
25%,清澈透明 |
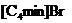 |
微波加热 |
5%-7% |
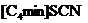 |
微波加热 |
5%-7% |
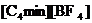 |
微波加热 |
不溶解 |
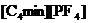 |
微波加热 |
不溶解 |
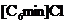 |
微波加热 |
5% |
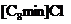 |
微波加热 |
微溶 |
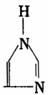
表中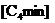 是1-(正)丁基-3-甲基咪唑正一价离子的代号,“咪唑”的结构为:
是1-(正)丁基-3-甲基咪唑正一价离子的代号,“咪唑”的结构为:

 假设在
假设在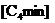 Cl里溶解了25%的聚合度n=500的纤维素,向该体系添加1.0%(质量)的水,占整个体系的物质的量分数为多少?假设添水后纤维素全部析出,析出的纤维素的物质的量分数为多大?
Cl里溶解了25%的聚合度n=500的纤维素,向该体系添加1.0%(质量)的水,占整个体系的物质的量分数为多少?假设添水后纤维素全部析出,析出的纤维素的物质的量分数为多大?

 20.(8分)泡沫灭火剂包括
20.(8分)泡沫灭火剂包括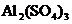 溶液(约1mol/L)、
溶液(约1mol/L)、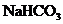 溶液(约1mol/L)及发泡剂.使用时发生的化学反应方程式是______________________________.
溶液(约1mol/L)及发泡剂.使用时发生的化学反应方程式是______________________________.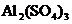 溶液和
溶液和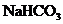 溶液的体积比约是____________.若用等体积、等浓度(mol/L)的
溶液的体积比约是____________.若用等体积、等浓度(mol/L)的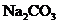 代替
代替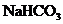 液,在使用时喷不出泡沫,这是因为__________________________.
液,在使用时喷不出泡沫,这是因为__________________________.
 泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸氢 钠溶液,不能把硫酸铝溶液盛在铁筒里的原因是___________________________________.
泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸氢 钠溶液,不能把硫酸铝溶液盛在铁筒里的原因是___________________________________.

 四、(本题包括两小题,共20分)
四、(本题包括两小题,共20分)


 21世纪教育网
21世纪教育网
13. 在100mL混合溶液中,
在100mL混合溶液中,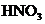 和
和 物质的量浓度分别为
物质的量浓度分别为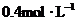 和
和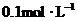 ,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中
,向该溶液中加入1.92g铜粉,加热,待充分反应后,所得溶液中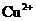 物质的量浓度(
物质的量浓度(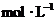 )为( )
)为( )


 21世纪教育网
21世纪教育网
 A.0.15 B.0.225
A.0.15 B.0.225
 C.0.35 D.0.45
C.0.35 D.0.45
 14.质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水.得到的溶液每毫升质量为q g,物质的量浓度为c.则溶质的分子量(相对分子质量)为( )
14.质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水.得到的溶液每毫升质量为q g,物质的量浓度为c.则溶质的分子量(相对分子质量)为( )
 A.
A.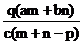 B.
B.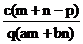
 C.
C.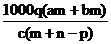 D.
D.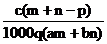
 15.在一定条件下,
15.在一定条件下,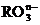 和氟气可发生如下反应:
和氟气可发生如下反应:

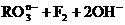

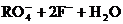
 从而可知在
从而可知在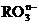 中,元素R的化合价是( )
中,元素R的化合价是( )
 A.+4 B.+5 C.+6 D.+7
A.+4 B.+5 C.+6 D.+7
 16.若以
16.若以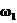 和
和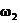 分别表示浓度为
分别表示浓度为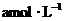 和
和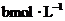 氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)( )
氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)( )
 A.
A.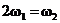 B.
B.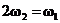
 C.
C.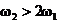 D.
D.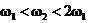

 第Ⅱ卷(非选择题,共56分)
第Ⅱ卷(非选择题,共56分)
 二、(本题包括两小题,共18分)
二、(本题包括两小题,共18分)
 17.(10分)CO是一种无色、无味且不溶于水的有毒气体,其制法有:
17.(10分)CO是一种无色、无味且不溶于水的有毒气体,其制法有:
 (1)实验室可用甲酸和浓
(1)实验室可用甲酸和浓 共热制取CO.
共热制取CO.

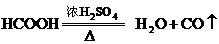
 a.甲酸和浓
a.甲酸和浓 应怎样混合?浓
应怎样混合?浓 起什么作用?
起什么作用?

 b.请据实验原理选择所需主要玻璃仪器(导管除外).
b.请据实验原理选择所需主要玻璃仪器(导管除外).

 c.怎样收集CO气体?
c.怎样收集CO气体?

 (2)实验室还可用草酸晶体与浓
(2)实验室还可用草酸晶体与浓 共热制取CO.
共热制取CO.

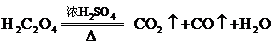
 请问:怎样才能得到不含
请问:怎样才能得到不含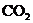 的CO气体?
的CO气体?

 (3)工业上用焦炭和水在高温下发生反应制取CO,其化学方程式为:____________
(3)工业上用焦炭和水在高温下发生反应制取CO,其化学方程式为:____________
 ____.在此条件下,C和
____.在此条件下,C和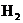 的还原性谁强?
的还原性谁强?

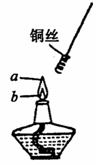
 18.(8分)如图,某同学做乙醇氧化实验时将螺旋状铜丝先放到a点处加热,然后再移到b点,发现铜丝在火焰的a,b两点时现象明显不同,请写出a,b两点的实验现象,并解释产生该现象的原因.
18.(8分)如图,某同学做乙醇氧化实验时将螺旋状铜丝先放到a点处加热,然后再移到b点,发现铜丝在火焰的a,b两点时现象明显不同,请写出a,b两点的实验现象,并解释产生该现象的原因.

|
|
实验现象 |
解 释 |
|
a |
|
|
|
b |
|
|
 三、(本题包括两小题,共18分)
三、(本题包括两小题,共18分)


 21世纪教育网
21世纪教育网
5. 同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和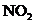 ,②
,②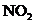 和
和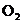 ,③
,③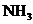 和
和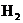 .现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为
.现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为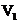 、
、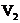 、
、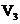 ,则下列关系正确的是( )
,则下列关系正确的是( )


 21世纪教育网
21世纪教育网
 A.
A.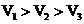 B.
B.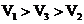
 C.
C.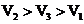 D.
D.
 6.当前,世界上日益严重的环境问题主要源于( )
6.当前,世界上日益严重的环境问题主要源于( )
 A.温室效应 B.厄尔尼诺现象
A.温室效应 B.厄尔尼诺现象
 C.人类对环境的污染和破坏 D.火同喷发和地震
C.人类对环境的污染和破坏 D.火同喷发和地震
 7.不粘锅的内壁有一薄层为聚四氟乙烯的涂层,用不粘锅烹烧饭菜时不易粘锅,下列关于聚四氟乙烯的说法正确的是( )
7.不粘锅的内壁有一薄层为聚四氟乙烯的涂层,用不粘锅烹烧饭菜时不易粘锅,下列关于聚四氟乙烯的说法正确的是( )
 A.聚四氟乙烯分子中含有双键
A.聚四氟乙烯分子中含有双键
 B.聚四氟乙烯的单体不是饱和烃
B.聚四氟乙烯的单体不是饱和烃
 C.聚四氟乙烯中氟的质量分数是76%
C.聚四氟乙烯中氟的质量分数是76%
 D.聚四氟乙烯的化学活泼性很大
D.聚四氟乙烯的化学活泼性很大
 8.生活中碰到的某些问题,常常涉及到化学知识,下列分析正确的是( )
8.生活中碰到的某些问题,常常涉及到化学知识,下列分析正确的是( )
 A.氯气和二氧化硫均可做漂白剂,若同时使用它们去漂白一湿润物质,漂白效果会明显增强
A.氯气和二氧化硫均可做漂白剂,若同时使用它们去漂白一湿润物质,漂白效果会明显增强
 B.为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中碘以单质形式存在
B.为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中碘以单质形式存在
 C.工业酒精不能加水而当美酒品尝,因其中含有甲醇,它虽然也具有酒香气味,但饮后会造成人的双目终生失明
C.工业酒精不能加水而当美酒品尝,因其中含有甲醇,它虽然也具有酒香气味,但饮后会造成人的双目终生失明
 D.苯酚有杀菌和止痛作用,药皂中也掺入少量的苯酚,所以我们可以用苯酚进行消毒或直接涂抹到皮肤上起消毒作用
D.苯酚有杀菌和止痛作用,药皂中也掺入少量的苯酚,所以我们可以用苯酚进行消毒或直接涂抹到皮肤上起消毒作用
 9.日本东京地方法院2002年10月11日以杀人罪判处邪教组织奥姆真理教骨干远藤诚一死刑.其因为参与制造1995年袭击东京地铁的沙林毒气而获罪.1995年3月20日,日本东京地铁发生震惊世界的“沙林”毒气袭击事件,造成11人死亡,5500多人受伤,恐怖分子使用的“沙林”是剧毒的神经毒剂,其化学名称为甲氟磷酸异丙酯.已知甲氟磷酸的结构式为
9.日本东京地方法院2002年10月11日以杀人罪判处邪教组织奥姆真理教骨干远藤诚一死刑.其因为参与制造1995年袭击东京地铁的沙林毒气而获罪.1995年3月20日,日本东京地铁发生震惊世界的“沙林”毒气袭击事件,造成11人死亡,5500多人受伤,恐怖分子使用的“沙林”是剧毒的神经毒剂,其化学名称为甲氟磷酸异丙酯.已知甲氟磷酸的结构式为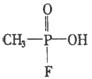 ,则“沙林”的结构简式是( )
,则“沙林”的结构简式是( )
 A.
A.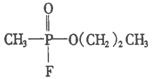 B.
B.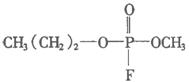
 C.
C.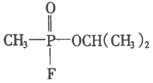 D.
D.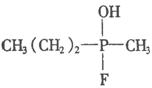
 10.关于反应
10.关于反应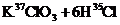

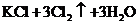 的有关叙述中,正确的是( )
的有关叙述中,正确的是( )
 A.KCl中含有
A.KCl中含有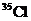
 B.KCl中含有
B.KCl中含有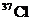
 C.生成物
C.生成物 的相对分子质量大于71
的相对分子质量大于71
 D.该反应转移电子数为
D.该反应转移电子数为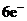
 11.下列事实不能用勒夏特列原理解释的是( )
11.下列事实不能用勒夏特列原理解释的是( )


 21世纪教育网
21世纪教育网
 A.氨水应密闭保存,放置于低温处
A.氨水应密闭保存,放置于低温处
 B.在硫酸亚铁溶液中,加入铁粉以防止氧化变质
B.在硫酸亚铁溶液中,加入铁粉以防止氧化变质
 C.生产硝酸的过程中使用过量空气以提高氨气的利用率
C.生产硝酸的过程中使用过量空气以提高氨气的利用率
 D.实验室常用排饱和食盐水的方法收集氯气
D.实验室常用排饱和食盐水的方法收集氯气
 12.为了实现流域环境的治理,甲、乙两相邻的工厂进行横向联合排污,已知两厂排放的污水经初步处理后,还溶有较大浓度的
12.为了实现流域环境的治理,甲、乙两相邻的工厂进行横向联合排污,已知两厂排放的污水经初步处理后,还溶有较大浓度的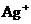 ,
,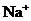 ,
,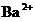 ,
,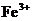 ,
,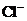 ,
,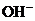 ,
,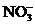 ,
,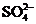 中各不相同的四种离子,若单独排放仍会造成环境污染,如果两厂的污水按适当比例混合,经沉淀后污水变成硝酸钠溶液,下列判断正确的是( )
中各不相同的四种离子,若单独排放仍会造成环境污染,如果两厂的污水按适当比例混合,经沉淀后污水变成硝酸钠溶液,下列判断正确的是( )
 A.
A.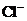 和
和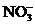 一定来自不同的工厂
一定来自不同的工厂
 B.
B.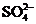 和
和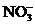 可能来自同一工厂
可能来自同一工厂
 C.
C.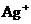 和
和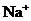 可能来自同一工厂
可能来自同一工厂
 D.
D.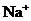 和
和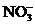 可能来自同一工厂
可能来自同一工厂
4. 已知在25℃,101kPa下,1g
已知在25℃,101kPa下,1g 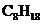 (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量.表示上述反应的热化学方程式正确的是( )
 A.
A.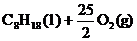

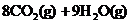

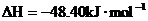
 B.
B.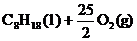

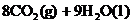

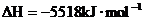
 C.
C.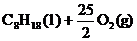

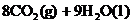

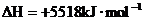
 D.
D.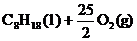

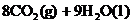

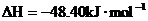
3.下列除去杂质的方法正确的是( )
A.除去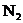 中的少量
中的少量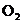 :通过灼热的CuO粉末,收集气体
:通过灼热的CuO粉末,收集气体
B.除去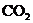 中的少量HCl:通入
中的少量HCl:通入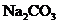 溶液,收集气体
溶液,收集气体
C.除去 溶液中的少量
溶液中的少量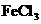 :加入足量铁屑,充分反应后,过滤
:加入足量铁屑,充分反应后,过滤
D.除去KCl溶液中的少量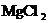 :加入适量NaOH溶液,过滤
:加入适量NaOH溶液,过滤
2.在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯 化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是( )
A.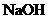 B.
B.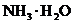
C.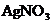 D.
D.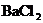
1.水资源非常重要,联合国确定2003年为国际淡水年.下列关于水的说法中错误的是( )
A.蒸馏法是海水淡化的方法之一
B.淡水的密度小于海水的密度
C.融化的雪水中矿物质含量比深井水中的少
D.0℃以上,温度越高,水的密度越小
28、某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
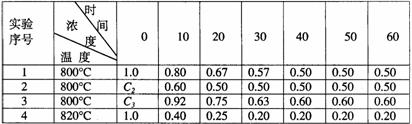
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度C2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1(填>、=、<),且C3 1.0mol/L(填>、=、<)
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是
27.Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+ 2Fe2++I2(水溶液)。
(1)在一定温度下,测得2min内生成I2的浓度为0.02mol/L,则用Fe3+表示该反应在这2min内平均反应速率为________________。
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K{c(I-)}m{c(Fe3+)}n(K为常数)
2Fe2++I2(水溶液)。
(1)在一定温度下,测得2min内生成I2的浓度为0.02mol/L,则用Fe3+表示该反应在这2min内平均反应速率为________________。
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K{c(I-)}m{c(Fe3+)}n(K为常数)
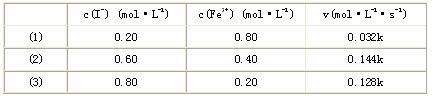
通过所给的数据计算得:在v=K{c(I-)}m{c(Fe3+)}n中。m、n的值为________________[选填(A)、(B)、(C)、(D)。 A.m=1,n=1 B.m=1,n=2 C.m=2,n=1 D.m=2,n=2 I-浓度对反应速率的影响________________Fe3+浓度对反应速率的影响。(选填:小于、大于、等于)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com