
3、已知同温同压下混合气体的密度是一种简单气体A的密度的倍数: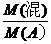 =
=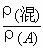
2、已知标准状况下混合气体的密度:M(混)=22.4ρ(混)
1、已知混合物质的总质量m(混)和总物质的量n(混):M(混)=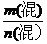
等几种。
2、步骤:
①计算:计算所需固体溶质质量或液体溶质的体积。
②称量:用托盘天平称量固体溶质或用量筒量取液体体积。
③溶解:将溶质加入小烧杯中,加适量水溶解。
④移液洗涤:将已溶解而且冷却的溶液转移到容量瓶中,并用玻璃棒引流,再洗涤烧杯和玻璃棒2-3次,将洗涤液倒入容量瓶中。
⑤定容:缓缓向容量瓶中注入蒸馏水,直到容量瓶液面接近刻度线1cm-2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切,盖好,反复上下颠倒,摇匀。
5、气体的溶解:在标准状况下,1L水中溶解某气体VL,所得溶液的密度为ρ
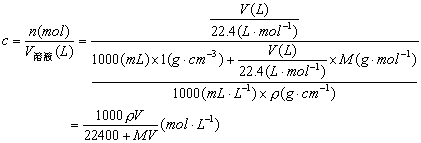
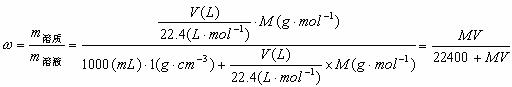
2、物质的量浓度与溶质的质量分数w的换算(ρ为溶液的密度)
c(mol·L-1)=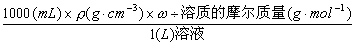 3、溶解度与溶质质量分数w的换算w=
3、溶解度与溶质质量分数w的换算w=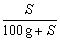 4、溶解度与物质的量浓度的换算
4、溶解度与物质的量浓度的换算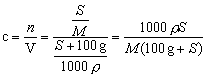 ,其中ρ的单位为:g/mL。
,其中ρ的单位为:g/mL。
5、一定物质的量浓度 主要仪器:量筒、托盘天平(砝码)、烧杯、玻璃棒、胶头滴管、容量瓶
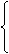 溶液的配配制: 方法步骤:计算→称量→溶解→转移→洗涤→振荡→定容→摇匀→装瓶
溶液的配配制: 方法步骤:计算→称量→溶解→转移→洗涤→振荡→定容→摇匀→装瓶
识差分析:关键看溶质或溶液体积的量的变化。依据 来判断。
来判断。
2、物质的量与其它量之间的换算恒等式:
|



 微粒的大小
1mol固、液体的体积
微粒的大小
1mol固、液体的体积
|

 物质体积
微粒的个数
1mol物质的体积
物质体积
微粒的个数
1mol物质的体积
 |
|||
|
|||

 微粒之间距离
1mol气体的体积
微粒之间距离
1mol气体的体积
 ①溶液稀释定律:溶质的量不变,m(浓)·w(浓)= m(稀)·w(稀);c(浓)·V(浓)=c(稀)·V(稀)
①溶液稀释定律:溶质的量不变,m(浓)·w(浓)= m(稀)·w(稀);c(浓)·V(浓)=c(稀)·V(稀)
|
③溶解度与物质的量浓度的换算: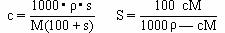
④质量分数与物质的量浓度的换算: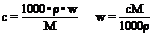
21.(本小题满分12分)
 已知双曲线C的方程为
已知双曲线C的方程为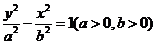 ,离心率
,离心率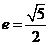 ,顶点到渐近线的距离为
,顶点到渐近线的距离为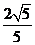 。
。
求双曲线C的方程;
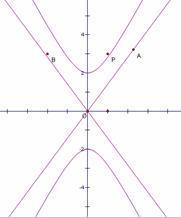
(II)如图,P是双曲线C上一点,A,B两点在双曲线C的两条渐近线上,且分别位于第一、二象限,若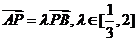 ,求
,求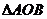 面积的取值范围。
面积的取值范围。
20.已知函数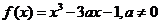
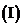 求
求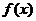 的单调区间;
的单调区间;
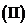 若
若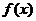 在
在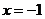 处取得极值,直线y=my与
处取得极值,直线y=my与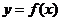 的图象有三个不同的交点,求m的取值范围。
的图象有三个不同的交点,求m的取值范围。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com