
1、某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的是
A.有1个氧原子 B.有2个氧原子 C.有1个A原子 D.有2个A原子
18.4mol/L×V(浓) =1.84 mol/L×0.5L
V(浓) =0.05L=50mL.
(2)量取:用量筒量准确取50 mL浓H2SO4。
(3)稀释:先在烧杯中放少量的蒸馏水,然后将浓H2SO4缓缓地沿着玻璃棒注入烧杯中,并不断地搅拌。
(4)移液洗涤:将已冷却的硫酸沿着玻璃棒缓慢地注入500mL的容量瓶中。洗涤烧杯2-3次,并将洗涤液也全部黑转移到容量瓶中
(5)定容摇匀:向容量瓶中缓缓注入蒸馏水至离容量瓶的刻度线1-2cm时,改用胶头滴管加蒸馏水至溶液的凹液面与溶量瓶的刻度线在水面平上相切。盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,反复上下颠倒摇匀,然后将所配的溶液倒入指定试剂瓶并贴好标签。
例7.在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g·cm-3,质量分数(质量百分比浓度)为w%,物质的量浓度为c mol·L-1,溶液中含氢氧化钠质量为m g。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为 。
(2)用m、V表示溶液中溶质的物质的量浓度c为 。
(3)用w、d表示溶液中溶质的物质的量浓度c为 。
(4)用c、d表示溶液中溶质的质量分数为 。
解析:这是一道只给出抽象符号的有关溶解度、质量分数、物质的量浓度的相互换算的问题。解答本题的关键是:在准确把握溶解度、溶液中溶质质量分数、溶液中溶质物质的量浓度的基础上,从未知求问的概念出发,进行概念分析,抓好相关概念的相互联系,便可顺利完成这种用符号表示的相互换算。
答案:(1)S=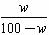 ×100 g
×100 g
(2)c=1000 mL·L-1×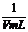 ×
×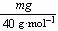 =
=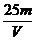 mol·L-1
mol·L-1
(3)c=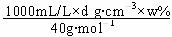 =0.25 dw
mol·L-1
=0.25 dw
mol·L-1
(4)w%=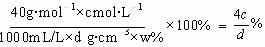
例8.相对于氢气密度为4.25的氢气和一氧化碳的混合物17g充分燃烧后,将产物全部依次通过足量的Na2O2和足量的氢硫酸溶液,溶液中淡黄色沉淀,假设气体全部参加反应,求:(1)Na2O2增加的质量;(2)生成的沉淀是什么?质量是多少?
解析:2H2 + O2 =2H2O,2CO+O2=2CO2
2Na2O2 +2H2O=4NaOH +O2↑,2Na2O2 +2CO2=2Na2CO3 +O2↑
2H2S +O2=2S↓+2H2O
(1)由以上反应可知,H2、CO混合气体燃烧耗O2量与产物通过足量Na2O2后生成O2的相同。因此Na2O2增加的质量即为H2、CO混合气的质量为17g
(2)由于H2、CO混合气体的平均相对分子质量为4.25 ×2=8.5
H2、CO的混合气体的物质的量为17g/8.5g·mol-1 =2mol
由2(H2、CO) ~ O2
2mol 1mol
可知通过Na2O2后产生的O2为1mol
由2H2S + O2 = 2S +2H2O
1mol 2mol
因此生成的沉淀为S,质量为2mol ×32g/mol=64g。
例9、在25℃101kPa下,将15L02通入10LCO和H2的混合气体中,使其完全燃烧,干燥后恢复至原来的温度和压强。
(1)若剩余气体的体积为15L,则原CO和H2的混合气中,V(CO)=_____L,V(H2)=_____L。
(2)若剩余气体体积为aL,则原CO和H2的混合气中,V(CO):V(H2)=__________。
(3)若剩余气体的体积为aL,则a的取值范围是__________。
解析:由反应原理2CO+O2=2CO2 ①
在同温、同压下CO和H2的混合气体
2H2+O2=2H2O ②
完全燃烧耗O2的体积为混合气体的1/2,即[V(CO)+V(H2)]=2V(O2)
(1)当V(CO)+V(H2)=10L时,要使其完全燃烧,必须有V(O2)≥5L。已知V(O2) =15L,则O2过量10L。又因反应后剩余气体的体积是15L,在25℃、101KPa条件下,水的状态为液体,则剩余气体为CO2和O2的混合气。故反应生成的二氧化碳的体积V(CO2)=5L,则由反应原理①得:V(CO)=5L,V(H2)=10-V(CO) =5L。
(2)由题(1)可以推理得:V(CO2)=(a-10)L;依反应原理①有V(CO)=(a-10)L;V(H2)=10L-(a-10)L =(20-a)L。则V(CO) :V(H2) =(a-10) : (20-a)。
(3)由题(2)结论有:(a-10):(20-a)>0;即(a-10)>0,20-a>0,所以10 <a< 20。
专题预测与训练
22.4L·mol–1) /(17g·mol–1×500L/22.4L·mol–1+1g·mL–1×1000mL)×100%=27.5%;
氨水的物质的量浓度为:c=ρg·mL–1×1000mL·L–1×ω/Mg·mol–1=0.9 g·mL–1×1000 mL·L–1×27.5%/17g·mol–1=14.6 mol·L–1。
例5.求98%的浓H2SO4(密度为1.84g/mL)的物质的量浓度。
解析:取浓H2SO4溶液的体积1L。
m[H2SO4(aq)]=ρ•V=1.84g/mL×1000mL=1840g
m(H2SO4)= m[H2SO4(aq)] •ω%=1840g×98%
n(H2SO4)=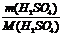 =
=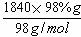 =18.4mol。
=18.4mol。
c(H2SO4)=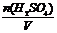 =18.4mol/L。
=18.4mol/L。
例6.如何用98%浓H2SO4(密度为1.84g/mL)来配制1.84mol/L的稀H2SO4溶液450mL?
解析:(1)计算:所需浓H2SO4的体积。
C(浓)V(浓)=c(稀)V(稀)
2.3g x y
列比例式解得:x=0.1mol,y=0.1mol。
生成0.1molNaOH在水中完全电离,故溶液中有0.1mol的Na+。
设与0.1mol Na+配比的水的物质的量为zmol。则有:
N(Na+)∶N(H2O)=n(Na+)∶n(H2O)
1∶100=0.1∶z, 解得:z=10mol。
所以,总共需H2O的物质的量为:
x+z=0.1mol+10mol=10.1mol。
m(H2O)=n(H2O) ×M(H2O)=10.1mol×18g/mol=181.8g。
例3.用1000g溶剂中所含溶质的物质的量来表示的溶液浓度叫做质量物质的量浓度,其单位是mol/kg。5mol/kg的硫酸的密度是1.2894g/cm3,则其物质的量浓度是( )
A.3.56mol/L B.5.23mol/L C.4.33mol/L D.5.00mol/L
解析:设溶剂的质量为1kg,则硫酸的体积为(5mol×98g·mol–1+1000g)÷1.2894g/cm3×10–3 L·mL–1≈1.155L,故硫酸的物质的量浓度c=5mol/1.155L≈4.33mol/L,所以答案为C。
例4.标准状况下,1体积水吸收500体积NH3后,所得氨水密度为0.9g·cm–3,求氨水中溶质的质量分数和氨水的物质的量浓度各为多少?
解析:设标准状况下,1L水溶解500NH3,则:
氨水中溶质的质量分数为:ω=m(NH3)/[m(NH3)+m(H2O)]×100%=(17g·mol–1×500L/
8、(桐乡高级中学高三化学10月考试卷)由10g含有杂质的CaCO3和足量盐酸反应,产生
了0.1 molCO2,试推断杂质的组成可能是 ( )
①KHCO3和MgCO3 ②K2CO3和SiO2 ③MgCO3和SiO2 ④Na2CO3和NaHCO3
A. ①② B. ③④ C. ②③ D. ①④
答案 B
典例解析
例1. 下图是几种盐的溶解度曲线,根据曲线判断下列说法正确的是( )
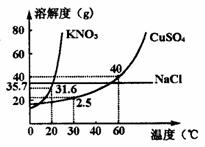
A.40℃时,35 g食盐溶于100 g水中,降温至0℃时,可析出氯化钠晶体
B.20℃时,硝酸钾饱和溶液的质量分数是31.6%
C.60℃时,200 g水中溶解80 g硫酸铜达饱和,当降温至30℃时,可析出30 g硫酸铜晶体
D.30℃时,将35 g硝酸钾和35 g食盐同时溶于100 g水中,蒸发时先析出的是氯化钠
例2. 2.3g金属钠与水反应后,所得的溶液中,要使每100个水分子中溶解有1个Na+,求所需水的质量。
解析:2.3g Na为0.1mol,产生的Na+也为0.1mol。设与0.1molNa反应消耗水的物质的量为xmol,
生成NaOH的物质的量为ymol。
2Na + 2H2O= 2NaOH +H2↑
46g 2mol 2mol
7、(江苏省南京市2009届高三年级质量检测).白云石化学式为CaCO3·x MgCO3。以它为原料,可制取耐火材料MgO等。称取27.6 g白云石样品,高温加热到质量不再变化,收集到CO2的体积为6.72 L(标准状况)。下列说法正确的是  ( )
( )
A.x=1
B.x=2
C.该样品高温条件下充分反应后剩余固体的质量是14.4g
D.该样品高温条件下充分反应后剩余固体中MgO的质量是4.0g
答案 AC
6、(白云中学2008-2009学年度高三第二次月考)某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是 ( )
|
|
50 mL盐酸 |
50 mL盐酸 |
50 mL盐酸 |
|
m(混合物) |
9.2g |
15.7g |
27.6g |
|
V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
A.盐酸的物质的量浓度为3.0mol/L
B.根据表中数据能计算混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
答案 D.
5、 (山东省聊城一中08-09学年度上学期高三期末综合测试)由10克含杂质的碳酸钙和足量的盐酸反应,产生标况下2.24升CO2,试推断杂质的组成可能是 ( )
A.碳酸镁和碳酸氢钾 B.碳酸镁和二氧化硅
C.碳酸钾和二氧化硅 D.碳酸氢钾和二氧化硅
答案 B
4.(山东省苍山荀子中学2009届高三第二次质检)为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。
[方案I](1)称取碳酸钙样品 M g;(2)加入过量盐酸;(3)收集并测定生成的气体体积 V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品 M g;(2)用c mol/L 盐酸 V mL(过量)溶解样品;(3)取溶解后的溶液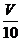 mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号)。
A.需要 B.不需要 C.均可
问题2:碳酸钙纯度计算公式 。
[方案Ⅲ](1)称取碳酸钙样品 M g;(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g。
问题:为什么要煅烧至1000℃且“直至质量不再改变”? 。
[方案IV](1)称取碳酸钙样品 M g;(2)加入足量Cmol/L盐酸V mL使之完全溶解;(3)过滤并取滤液;(4)在滤液中加入过量C′mol/L Na2CO3溶液V′mL;(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题1:此方案中不需要的数据是 (填选项编号)。
A.C、V B.C′、 V′ C. M′ D. M
问题2:为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液体积V′ mL
B.精确配制浓度C′mol/LNa2CO3溶液
C.将步骤(3)所得滤渣洗涤,洗涤液也应并入(4)中
D.将步骤(3)所得滤渣洗涤、干燥、称量其质量M′′g备用
综上所述,你认为4个方案中,最好的方案是 ,其它方案的缺点分别是:
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案 ; 。
方案 ; 。
答案 方案Ⅰ:偏低 方案Ⅱ: ① B 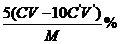 方案Ⅲ:保证CaCO3完全
分解 方案Ⅳ:①A、B ②C
方案Ⅱ(1分)方案Ⅰ:气体体积难以准确测量
方案Ⅲ:实验室难以提供1000℃的高温
方案Ⅲ:保证CaCO3完全
分解 方案Ⅳ:①A、B ②C
方案Ⅱ(1分)方案Ⅰ:气体体积难以准确测量
方案Ⅲ:实验室难以提供1000℃的高温
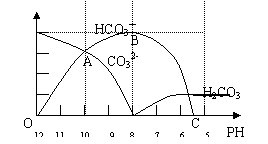
3.(北京市宣武区2007年高考化学模拟试题)常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的PH值逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如下图所示
回答下列问题:
(1)在0.1mol/L Na2CO3溶液中C(Na+):C(CO32-) 2(填“﹤”或“﹥”或“=”)。其溶液中所有阳离子和阴离子的浓度有何关系?(用等式表示) 。
(2)在20mL 0.1mol/LNa2CO3溶液中加入BaCl2粉末3.328×10-7g时开始产生沉淀X,则
KSP(X)= 。
(3)当加入盐酸使溶液PH值为10时,混合液中含碳元素的离子有哪些? ,其物质的量之比为 。
(4)随着盐酸的加入,HCO3-离子的浓度变化趋势是 ;请写出OAB段的离子方程式 和BC段的离子方程式 。
(5)当混合液的PH= 时,开始放出CO2气体。
答案(1)﹥;C(Na+)+C(H+)=2C(CO32-)+C(HCO3-)+C(OH-)
(2)8.0×10-9
(3)CO32-和HCO3- 1:1
(4)先增大后又减小 CO32-+H+=HCO3- HCO3-+H+=CO2↑+H2O或HCO3-+H+= H2CO3
(5)6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com