
3.函数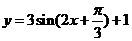 的最小正周期为
的最小正周期为
A.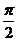 B.
B.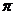 C.
C.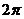 D.
D.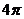
2.函数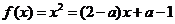 是偶函数,则曲线
是偶函数,则曲线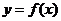 在
在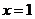 处的切线方程是
处的切线方程是
A.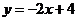 B.
B.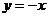 C.
C.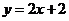 D.
D.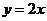
1.已知集合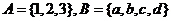 ,则
,则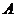 到
到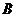 的不同映射个数共有
的不同映射个数共有
A.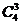 B.
B.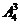 C.
C.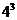 D.
D.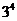
28、现有等物质的量的NaHCO3和KHCO3的混合物ag与100mL盐酸反应。题中涉及的气体体积均以标准状况计,填空时可以用带字母的公式表示。
(1)该混合物中NaHCO3和KHCO3的质量比为____ ________
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的浓度为____ ________
(3)如盐酸过量,生成CO2体积为__________
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道________________________________________ __。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则ag固体混合物与足量的盐酸完全反应时生成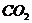 的体积(V)范围是___
__。
的体积(V)范围是___
__。
27、过氧化钠和碳酸氢钠的混合物,等质量分为两份,其中一份加入100mL盐酸溶液使其充分反应呈中性,放出气体2.24L(标况);将其气体通入另一份混合物中充分反应后,气体的体积变为2.016L(标况)求:
(1)原混合物中过氧化钠和碳酸氢钠的物质的量之比
(2)盐酸溶液的物质的量的浓度
26、在有机溶剂里,使n mol PCl5与n mol NH4Cl发生完全反应,释放出4n molHCl,同时得到一种白色晶体A,A的熔点为113℃,在减压时,50℃即可升华,测得A蒸气的密度(标准状况)为15.5g·L-1。
(1)通过计算得出A的化学式_______ ____。
(2)生成A晶体的化学方程式为_____________________________________________。
(3)分子结构测定结果表明,同种元素的原子在A分子中所处的环境毫无差别,试写出A的结构式:________ __。
25、氢氧化镁难溶于水,但它所溶解的那一部分则在溶液中完全电离。常温时,饱和氢氧化镁溶液(溶液密度为1.0g.cm-3)中的c(Mg2+)=5×10-4mol.L-1,请填写下列空白:
(1)该溶液中OH-离子的物质的量浓度为_______ _______。
(2)该溶液中溶质的质量分数为__________ ___________。
(3)该温度下氢氧化镁的溶解度是_______ ____________。
24、下面是关于硫化氢的部分文献资料:

某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1-2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
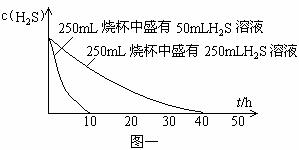
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。

实验三:在饱和氢硫酸溶液中以极慢的速度通入空气(1-2个气泡/min),数小时未见变浑浊的现象,如图三。
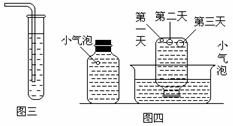
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2-3天观察,直到略显浑浊。当把满瓶的氢硫酸倒扣在培养皿中观察2-3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊也更明显些,如图四。
请回答下列问题:
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是________
。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为___________________。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应。___________________________________。
(3)“氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了___ _的缘故。
(4)该研究性学习小组设计实验三说明他们认为“氢硫酸长期存放会浑浊”的假设原因之一是(用文字说明)___________ ____________。此实验中通入空气的速度很慢的主要原因是什么?_____________________ ______。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是______。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字简单说明实验设想,不需要回答实际步骤和设计实验方案)?______ ________。
23、今有86 g酒石酸样品,其中混有8 g琥珀酸。现要将该样品用结晶法提纯
酒石酸,不同温度下两者溶解度见下表(两者共存时不影响各自的溶解度)。
|
温度(℃) |
20 |
30 |
40 |
50 |
70 |
80 |
|
酒石酸溶解度(g/100 g水) |
18 |
25 |
37 |
65 |
81 |
98 |
|
琥珀酸溶解度(g/100 g水) |
7 |
11 |
16 |
36 |
51 |
71 |
⑴80℃时,溶解该样品,应加__________g水(取10的整数倍)最合适。
⑵将该混合液从80℃冷却到20℃,能否析出纯净的酒石酸晶体?答:_____ _____。请通过计算说明你得出该结论的理由 。
⑶要使混合液尽可能多地析出纯净的酒石酸晶体,冷却温度最低为________℃(取10的整数倍),此温度下能析出酒石酸晶体__________g。
22、(1)将Wg胆矾(CuSO4·5H2O)溶解在VmL水中,得到饱和溶液,测得该饱和溶液的密度为ρg/cm3,测溶液的物质的量浓度为 。
(2)化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10mLA气体能分解生成15mLO2和10mLF2(同温、同压)。
①A的化学式是______ _____。推断理由是______________________________
____________________________ _______。
②已知A分子中x个氧原子呈…O-O-O…链状排列,则A分子的电子式是_________,
A分子的结构式是__________ ___ ____。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com