
9.(1 6分)氮和磷是VA族的两种重要元素。
(1)磷的氧化物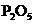 跟冷水反应生成偏磷酸(偏磷酸可以看作是磷酸脱去1分子水的产物),写出该反应的方程式:_________________________,偏磷酸是_____________元酸。
跟冷水反应生成偏磷酸(偏磷酸可以看作是磷酸脱去1分子水的产物),写出该反应的方程式:_________________________,偏磷酸是_____________元酸。
(2)用NH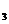 为原料制硝酸,发生在氧化炉中的反应方程式是_______________________浓硝酸跟甲苯反应的方程式是.__________________________。
为原料制硝酸,发生在氧化炉中的反应方程式是_______________________浓硝酸跟甲苯反应的方程式是.__________________________。
(3)汽车尾气中含有较多的NO2,空气中的NO2在阳光照射下会形成_____________。
已知:N2O4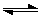 2NO2,下图a、b为容器,a不带活塞,容积保持不变;b带活塞,压强保持不变。在同温同压时,分别将nmoI
N2O4气体充人“起始态”体积相同的容器a、b中进行反应。
2NO2,下图a、b为容器,a不带活塞,容积保持不变;b带活塞,压强保持不变。在同温同压时,分别将nmoI
N2O4气体充人“起始态”体积相同的容器a、b中进行反应。
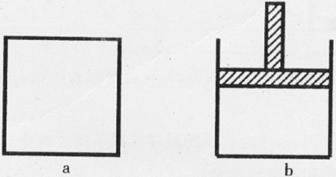
反应开始时,a和b中N2O4的分解速率v(a)___________v(b),反应过程中N2O4的分解速率v(a)____________v(b)(填“>”、“<”或“=”)。反应达平衡后,若在a中再充入,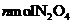 ,则再次平衡时N2O4的分解率将________ (填“增大”、“减小”或“不变”)。
,则再次平衡时N2O4的分解率将________ (填“增大”、“减小”或“不变”)。
8、(本题18分,每空3分)(1) :
:

 (2)
(2)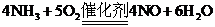 (没有反应条件扣1分)
(没有反应条件扣1分)
(3)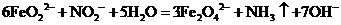
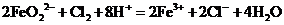
 (4)
(4)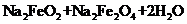

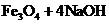
(5)太大
8. (本题18分)有下列物质之间的相互转化:
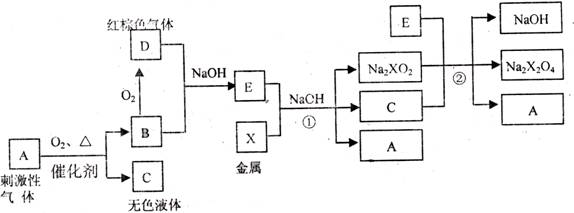
已知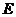 是具有还原性的含氧酸钠盐,回答下列问题(方程式中的物质用对应的元素符号或化学式表示)
是具有还原性的含氧酸钠盐,回答下列问题(方程式中的物质用对应的元素符号或化学式表示)
(1) 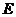 的化学式是
的化学式是
(2)写出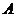 和
和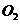 反应生成
反应生成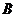 和
和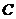 的方程式
。
的方程式
。
(3) 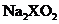 和
和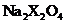 均为易溶于水的盐。
均为易溶于水的盐。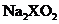 溶于过量的新制氯水后形成黄色溶液,向该溶液中滴入
溶于过量的新制氯水后形成黄色溶液,向该溶液中滴入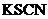 溶液出现血红色。写出反应②以及
溶液出现血红色。写出反应②以及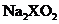 溶于过量氯水的离子方程式
、 。
溶于过量氯水的离子方程式
、 。
 (4)事实上,金属
(4)事实上,金属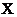 放置于一定浓度
放置于一定浓度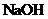 和
和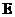 混合溶液中一段时间,发生反应①、②,生成的
混合溶液中一段时间,发生反应①、②,生成的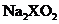 和
和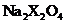 能发生可逆反应,在
能发生可逆反应,在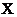 表面生成一层致密的氧化物保护层。试写出
表面生成一层致密的氧化物保护层。试写出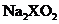 和
和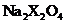 相互反应生成保护层的化学反应方程式
。
相互反应生成保护层的化学反应方程式
。
(5)为防止金属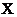 的腐蚀,将
的腐蚀,将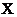 制品放置于一定浓度
制品放置于一定浓度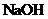 和
和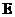 混合溶液中时,
混合溶液中时,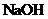 的浓度不宜 (填“太小”或“太大”)。
的浓度不宜 (填“太小”或“太大”)。
7. 下列说法正确的是(D )
 A.使湿润的蓝色石蕊试纸变红的气体一定是氯化氢气体
A.使湿润的蓝色石蕊试纸变红的气体一定是氯化氢气体
B.某气体通入石灰水中产生白色沉淀,再加足量的盐酸,白色沉淀消失,则该气体一定是CO2
C.常温下,向某溶液中滴加无色酚酞试液,溶液变红,则该溶液一定是碱溶液
D.向某溶液中加入少量的KSCN溶液出现血红色,则该溶液中含有Fe3+
6.以下离子方程式正确的是( B )
 A. 氧化铁溶于氢碘酸:Fe2O3+6H+ = 2Fe3++3H2O
A. 氧化铁溶于氢碘酸:Fe2O3+6H+ = 2Fe3++3H2O
 B. 等物质的量的KHCO3和Ba(OH)2的溶液混合:HCO3-+Ba2++OH- =
BaCO3↓+H2O
B. 等物质的量的KHCO3和Ba(OH)2的溶液混合:HCO3-+Ba2++OH- =
BaCO3↓+H2O
 C.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑
C.过氧化钠固体与水反应:2O22-+2H2O=4OH-+O2↑

 D. 硫化钠水溶液呈碱性的原因:S2-+2H2O
D. 硫化钠水溶液呈碱性的原因:S2-+2H2O 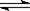 H2S↑+2OH-
H2S↑+2OH-
5.下列叙述不正确的是( C )
 A.常温下,10mL0.02 mol/L HCl溶液与10mL0.02 mol/L
Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
A.常温下,10mL0.02 mol/L HCl溶液与10mL0.02 mol/L
Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
 B.在0.1 mol/LHCOONa溶液中,C(OH-)=C(HCOOH)+C(H+)
B.在0.1 mol/LHCOONa溶液中,C(OH-)=C(HCOOH)+C(H+)
 C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
 D.苯酚、淀粉KI、乙酸、氢氧化钾四种溶液可用 FeCl3溶液一次鉴别
D.苯酚、淀粉KI、乙酸、氢氧化钾四种溶液可用 FeCl3溶液一次鉴别
4.“神舟”号载人航天器中,宇航员所在的轨道和返回舱都是密封的,宇航员吸入氧气,呼出二氧化碳,如果二氧化碳浓度过高,会使宇航员困乏,呼吸频率加快,严重的会窒息,为使二氧化碳浓度降低而保持舱内氧气的适当比例,可以在航天舱内放入 ( C )
 A.Na2CO3
B.NaOH
C.Na2O2
D.CaO
A.Na2CO3
B.NaOH
C.Na2O2
D.CaO
3.已知外电路中,电子由铜流向a极。 有关下图所示的装置分析合理的一项是B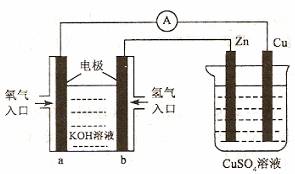
A.该装置中Cu极为正极
B.当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L
C.b极反应的电极反应式为:H2-2e-=2H+
D.一段时间后锌片质量减少
2. 某温度下,将2mo1A和3mo1B充入一密闭容器中,发生反应:aA(g)+B(g)
某温度下,将2mo1A和3mo1B充入一密闭容器中,发生反应:aA(g)+B(g) C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化, 则 ( AC )
C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化, 则 ( AC )
 A.a=1 B.a =2 C.B的转化率为40 % D.B的转化率为60 %
A.a=1 B.a =2 C.B的转化率为40 % D.B的转化率为60 %
1. 氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不包含氧化还原反应的是( B )

 A.冶炼金属铝 B.点制豆腐 C.食物腐败 D.燃放鞭炮
A.冶炼金属铝 B.点制豆腐 C.食物腐败 D.燃放鞭炮
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com