
4、恒压(温)线
该类图象的纵坐标为物质的平衡浓度或反应物的转化率,横坐标为温度或压强.
例5 、对于反应2A(g)+B(g) 2C(g);△H<0,下列图象正确的是 ()
2C(g);△H<0,下列图象正确的是 ()
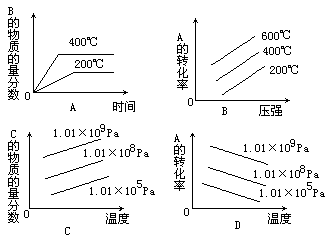
解析:首先要知道该反应是气体体积缩小的放热反应.此反应的平衡体系受压强的影响是:增大压强平衡向正反应方向移动,A的转化率增大,B的含量减小,C的含量增大.升高温度,平衡向逆反应方向移动,A的转化率减小,B的含量增大,C的含量减小.A图象虽表示B的含量随温度升高而增加,但若平衡是从C物质开始反应而建立的,则符合此反应.另外,从反应开始到建立平衡,温度越高,到达平衡的时间越短.由于该反应是放热反应,建立平衡后,温度越高,B的含量就应越大.因此A、D图象正确,符合上述平衡体系,B、C图象不符合题意.
3、含量-时间-温度(压强)图
这类图象反映了反应物或生成物的量在不同温度(压强)下对时间的关系,解题时要注意一定条件下物质含量不再改变时,应是化学反应达到平衡的特征.
例3、同压、不同温度下的反应:
A(g)+B(g) C(g);△H
C(g);△H
A的含量和温度的关系如图3所示,下列结论正确的是 ( )
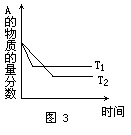
A.T1>T2,△H>0 B.T1<T2,△H>0 C.T1>T2,△H<0 D.T1<T2,△H<0
解析:在其他条件不变的情况下,升高温度加快反应速率,缩短反应到达平衡的时间.由图象可知,T1温度下,反应先达平衡,所以T1>T2.在其他条件不变的情况下,升高温度平衡向吸热方向移动,降低温度平衡向放热方向移动.因为T1>T2,达平衡时T1温度下A的含量较大,即A的转化率降低,所以升温时平衡向逆反应方向移动.因此该反应的正方向为放热反应,即△H<0,故正确答案选C.
例4、 现有可逆反应A(g)+2B(g) nC(g);△H<0,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是()
nC(g);△H<0,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是()
A.p1>p2,n>3 B.p1<p2,n>3 C.p1<p2,n<3 D.p1>p2,n=3
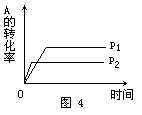
解析:当其他条件不变时,对于有气体参加的可逆反应,压强越大,到达平衡的时间越短.图象中曲线和横轴平行,表明反应已达平衡.由图象知道,当压强为p2时,该反应到达平衡的时间较短,故p1<p2.在其他条件不变的情况下,增大压强会使化学平衡向着气体体积缩小的方向移动.因p1<p2,且当压强为p1时,A的转化率较大,所以正反应为气体体积增加的反应,即1+2<n,故正确答案选B.
2、浓度-时间图
此类图象能说明各平衡体系组分(或某一成分)在反应过程中的变化情况.解题时要注意各物质曲线的折点(达平衡时刻),各物质浓度变化的内在联系及比例符合化学方程式中化学计量数关系等情况.
例2、图2表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间.试回答:(1)该反应的反应物是______;(2)反应物的转化率是______;(3)该反应的化学方程式为______.
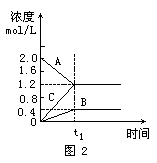
解析:起始时A的浓度为2.0mol/L,B、C的浓度为0,随着时间的推移,A的浓度降低为1.2mol/L,C的浓度升高为1.2mol/L,B的浓度升高为0.4mol/L.t1时刻后各物质浓度不再变化,说明反应已达平衡,得出A为反应物,B、C为产物,它们浓度变化的差值之比为化学方程式中各物质的化学计量数之比.故正确答案为(1)A;(2)40%;(3)2A=B+C.
1、速率-时间图
此类图象定性地揭示了v正、v逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向.
例1、对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为( )
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为( )
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
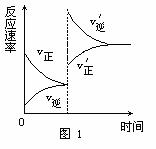
解析:经常有一些同学错选B,认为增大压强,平衡向气体体积缩小的方向移动.其实,图象告诉我们的是:增大压强,加快了正、逆反应,但逆反应速率增大的幅度大于正反应速率增大的幅度,由此而导致平衡向左移动.而压强的改变,只影响气体反应的速率,选项B所言的X、Y皆非气体即其正反应速率不受影响,故正确答案为A.
1、等效平衡:在两种不同的初始状态下,同一个可逆反应在一定条件(定温、定容或定温、定压)下分别达到平衡时,各组成成分的物质的量(或体积)分数相等的状态。在恒温恒容条件下,建立等效平衡的一般条件是:反应物投料量相当;在恒温恒压条件下,建立等效平衡的条件是:相同反应物的投料比相等。 2、平衡移动的思维基点: (1)“先同后变”,进行判断时,可设置相同的平衡状态(参照标准),再根据题设条件观察变化的趋势; (2)“不为零原则”,对于可逆反应而言,无论使用任何外部条件,都不可能使其平衡体系中的任何物质浓度变化到零。 3、在实际生产中,需要综合考虑反应速率、化学平衡、原料选择、产量和设备等各方面情况,以确定最佳生产条件。合成氨选择的适宜条件通常是:20MPa-50MPa、500℃左右、铁触媒;及时补充N2和H2,及时将生成氨分离出来。
|

速率平衡图象常见类型
解题策略:(1)首先要看清楚横轴和纵轴意义(特别是纵轴。表示转化率和表示反应物的百分含量情况就完全相反)以及曲线本身属等温线还是等压线。(当有多余曲线及两个以上条件时,要注意“定一议二”)(2)找出曲线上的特殊点,并理解其含义。(如“先拐先平”) (3)根据纵轴随横轴的变化情况,判定曲线正确走势,以淘汰错误的选项。
2、有关化学平衡的基本计算
(1)物质浓度的变化关系
反应物:平衡浓度=起始浓度-转化浓度
生成物:平衡浓度=起始浓度+转化浓度
其中,各物质的转化浓度之比等于它们在化学方程式中物质的计量数之比。
(2)反应的转化率(α):α= ×100%
×100%
(3)在密闭容器中有气体参加的可逆反应,在计算时经常用到阿伏加德罗定律的两个推论:
恒温、恒容时: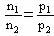 ;恒温、恒压时:n1/n2=V1/V2
;恒温、恒压时:n1/n2=V1/V2
(4)计算模式
浓度(或物质的量) aA(g)+bB(g) 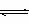 cC(g)+dD(g)
cC(g)+dD(g)
起始 m n O O
转化 ax bx cx dx
平衡 m-ax n-bx cx dx
α(A)=(ax/m)×100%
ω(C)=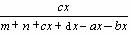 ×100%
×100%
(3)化学平衡计算的关键是准确掌握相关的基本概念及它们相互之间的关系。化学平衡的计算步骤,通常是先写出有关的化学方程式,列出反应起始时或平衡时有关物质的浓度或物质的量,然后再通过相关的转换,分别求出其他物质的浓度或物质的量和转化率。概括为:建立解题模式、确立平衡状态方程。说明: ①反应起始时,反应物和生成物可能同时存在; ②由于起始浓度是人为控制的,故不同的物质起始浓度不一定是化学计量数比,若反应物起始浓度呈现计量数比,则隐含反应物转化率相等,且平衡时反应物的浓度成计量数比的条件。 ③起始浓度,平衡浓度不一定呈现计量数比,但物质之间是按计量数反应和生成的,故各物质的浓度变化一定成计量数比,这是计算的关键。
1、化学平衡常数
(1)化学平衡常数的数学表达式
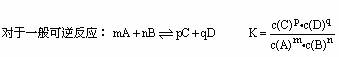
(2)化学平衡常数表示的意义
平衡常数数值的大小可以反映可逆反应进行的程度大小,K值越大,反应进行越完全,反应物转化率越高,反之则越低。
20.根据下面的新闻材料,拟一条新闻标题,不超过20字。(5分)
昨日,负责曹操墓发掘的河南省文物考古研究所在郑州举办曹操高陵考古发现说明会,就对大家关心的曹操谥号问题、出土石碑刻铭真伪等问题一一进行澄清与答复。
有专家认为,墓穴没有发现墓志铭非常遗憾,也缺乏有力证据。孙新民则表示,该墓葬中没有发现墓志铭是符合客观历史事实的。东汉时期流行墓前立碑,埋入墓中的石刻是不多见的。魏晋之后的南北朝时期,墓志铭葬俗才逐步定型。目前,最早的墓葬志铭发现在公元464年,距曹操死亡的时间相距约240余年。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com