
12、1mol
X气体跟a rnol Y气体在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)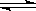 b
Z(g)反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
b
Z(g)反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A.a=1,b=1 B.a=2,b=1 C.a=2,b=2 D.a=3,b=2
11、在一定温度下,向a L密闭容器中加入1mol X气体和2
mol Y气体,发生如下反应:X(g)+2Y(g)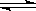 2Z(g) 此反应达到平衡的标志是
2Z(g) 此反应达到平衡的标志是
A.容器内压强不随时间变化 B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1︰2︰2 D.单位时间消耗0.1mol X同时生成0.2mol Z
10、放热反应CO(g)+H2O(g)
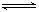 CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.K2 和K1的单位均为mol/L B.K2 <K1
C.c2(CO)=c2(H2O) D.c1(CO)>c2(CO)
9、压强变化不会使下列化学反应的平衡发生移动的是
A.H2(g)+ I2(g) 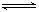 2 HI(g)
B.3H2(g)+N2(g)
2 HI(g)
B.3H2(g)+N2(g) 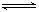 2NH3(g)
2NH3(g)
C.2SO2(g)+O2(g) 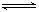 2SO3(g) D.C(s)+ CO2(g)
2SO3(g) D.C(s)+ CO2(g) 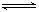 2CO(g)
2CO(g)
8、反应:L(固)+aG(气)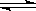 bR(气)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
bR(气)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2, x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
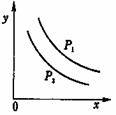
A.上述反应是放热反应 B.上述反应是吸热反应 C.a>b D.a<b
7、对于反应2SO2+O2 2SO3,下列判断正确的是
2SO3,下列判断正确的是
A.2体积2SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速度必定等于O2生成速度的两倍
D.平衡时,SO2浓度必定等于O2浓度的两倍
6、同温同压下,当反应物分解了8%时,总体积也增加8%的是
A.2NH3(g)
 N2(g)+3H2(g)
B.2NO(g)
N2(g)+3H2(g)
B.2NO(g)  N2(g)+O2(g)
N2(g)+O2(g)
C.2NO3(g)  4NO2(g)+O2(g)
D.2NO2(g)
4NO2(g)+O2(g)
D.2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
5.在容积固定的密闭容器中存在如下反应:A(g)+3B(g)
 2C(g);△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g);△H<0。某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
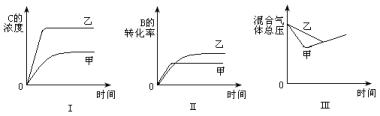
下列判断一定错误的是( ) A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高 C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高 D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
1.100mL6mol/L的H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.Na2SO4固体 C.NaOH溶液 C.K2SO4溶液 D.CuSO4固体
2.下列事实中,不能用勒·沙特列原理解释的是( )
A.开启啤酒后,瓶中马上泛起大量泡沫
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
3.NO2溶于水生成硝酸的反应为:3NO2(g)+H2O(1)  2HNO3(1)+NO(g);△H<0。为了提高硝酸的产率,工业生产中常采取的措施是( )
A.升温 B.加水 C.通往过量的氧气 D.减压
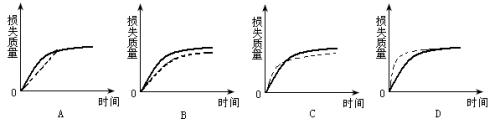
4.将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图的实线所示,在相同的条件下,将b g(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
2HNO3(1)+NO(g);△H<0。为了提高硝酸的产率,工业生产中常采取的措施是( )
A.升温 B.加水 C.通往过量的氧气 D.减压
4.将a g块状碳酸钙跟足量盐酸反应,反应物损失的质量随时间的变化曲线如图的实线所示,在相同的条件下,将b g(a>b)粉末状碳酸钙与同浓度盐酸反应,则相应的曲线(图中虚线所示)正确的是( )
5.速率-温度(压强)图
例6、
对于可逆反应:A2(g)+3B2(g) 2AB3(g);△H<0,下列图象中正确的是 ()
2AB3(g);△H<0,下列图象中正确的是 ()
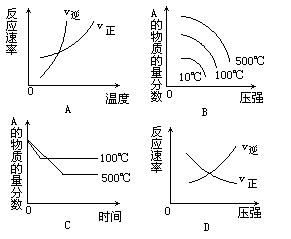
解析:该反应的正反应是气体体积缩小且放热的反应.图象A正确,因为温度升高,正逆反应都加快,在二曲线相交处可逆反应达到平衡,交点后逆反应速率的增加更为明显,与正反应是放热反应相符.针对该反应特点,只升温而使平衡向逆反应方向移动,A的含量增加;只加压而使平衡向正反应方向移动,A的含量减少,B也正确.对可逆反应,温度越高,到达平衡的时间越短,C不合题意.图象D表示的意义是:增大压强逆反应速率的加快比正反应明显,与本反应是气体体积减小的特点相悖,故正确答案为A,B
|

[例1](2010重庆卷,10)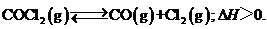 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
答案B
[解析]本题考查化学平衡的移动。该反应为体积增大的吸热反应,所以升温和减压均可以促使反应正向移动。恒压通入惰性气体,相当于减压。恒容通入惰性气体与加催化剂均对平衡无影响。增加CO的浓度,将导致平衡逆向移动。
[方法提炼]对于恒容容器,通入稀有气体,由于容器的体积不变,各组分的浓度保持不变,故反应速率保持不变,平衡也即不移动。若为恒压容器,通入稀有气体,容器的体积膨胀,对于反应则相当于减压。
[例2](2010四川理综卷,13)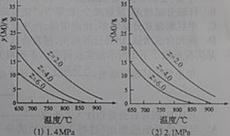 反应aM (g)+bN(g)
反应aM (g)+bN(g) 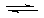 cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
A.同温同压Z时,加入催化剂,平衡时Q的体积分数增加
B.同压同Z时,升高温度,平衡时Q的体积分数增加
C.同温同Z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加Z,平衡时Q的体积分数增加。
答案:B
解析:本题考查了平衡移动原理的应用。A项加入催化剂只能改变反应速率,不会使平衡移动。B项由图像(1)知随着温度的升高M的体积分数降低,说明正反应吸热,所以温度升高平衡正向移动,Q的体积分数增加。C项对比(1)(2)可以看出相同温度条件,压强增大M的体积分数增大,所以正反应是体积缩小的反应,增大压强Q的体积分数减小。D项由C项可以判断D也不对。
[例3](2010全国卷1,27)(15分)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为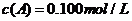 、
、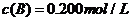 及
及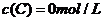 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
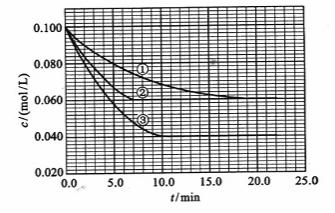
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②_______________;
③_______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的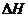 _________0,判断其理由是__________________________________;
_________0,判断其理由是__________________________________;
(4)该反应进行到4.0min时的平均反应速度率:
实验②: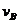 =__________________________________;
=__________________________________;
实验③: =__________________________________。
=__________________________________。
[解析](1)②使用了(正)催化剂;理由:因为从图像可看出,两者最终的平衡浓度相同,即最终的平衡状态相同,而②比①所需要的时间短,显然反应速率加快了,故由影响反应速率和影响平衡的因素可知是加入(正)催化剂;③升高温度;理由:因为该反应是在溶液中进行的反应,所以不可能是改变压强引起速率的改变,又由于各物质起始浓度相同,故不可能是改变浓度影响反应速率,再由于③和①相比达平衡所需时间短,平衡时浓度更小,故不可能是改用催化剂,而只能是升高温度来影响反应速率的
(2)不妨令溶液为1L,则②中达平衡时A转化了0.04mol,由反应计量数可知B转化了0.08mol,所以B转化率为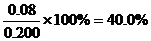 ;同样在③中A转化了0.06mol,则生成C为0.06mol,体积不变,即平衡时C(c)=0.06mol/L
;同样在③中A转化了0.06mol,则生成C为0.06mol,体积不变,即平衡时C(c)=0.06mol/L
(3) 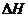 ﹥0;理由:由③和①进行对比可知升高温度后A的平衡浓度减小,即A的转化率升高,平衡向正方向移动,而升温是向吸热的方向移动,所以正反应是吸热反应,
﹥0;理由:由③和①进行对比可知升高温度后A的平衡浓度减小,即A的转化率升高,平衡向正方向移动,而升温是向吸热的方向移动,所以正反应是吸热反应,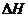 ﹥0
﹥0
(4)从图上读数,进行到4.0min时,实验②的A的浓度为:0.072mol/L,则△C(A)=0.10-0.072=0.028mol/L,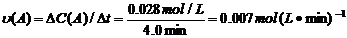 ,∴
,∴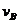 =2
=2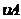 =0.014mol(L·min)-1;进行到4.0mi实验③的A的浓度为:0.064mol/L:△C(A,) =0.10-0.064=0.036mol/L,
=0.014mol(L·min)-1;进行到4.0mi实验③的A的浓度为:0.064mol/L:△C(A,) =0.10-0.064=0.036mol/L,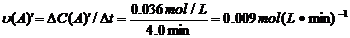 ,∴
,∴ =
=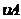 =0.0089mol(L·min)-1
=0.0089mol(L·min)-1
[答案](1)②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变
③温度升高;达到平衡的时间缩短,平衡时A的浓度减小
(2)40%(或0.4);0.06mol/L;(3)﹥;升高温度向正方向移动,故该反应是吸热反应
(4)0.014mol(L·min)-1;0.008mol(L·min)-1
[命题意图]考查基本理论中的化学反应速率化学平衡部分,一些具体考点是:易通过图像分析比较得出影响化学反应速率和化学平衡的具体因素(如:浓度,压强,温度,催化剂等)、反应速率的计算、平衡转化率的计算,平衡浓度的计算,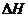 的判断;以及计算能力,分析能力,观察能力和文字表述能力等的全方位考查。
的判断;以及计算能力,分析能力,观察能力和文字表述能力等的全方位考查。
[点评]本题所涉及的化学知识非常基础,但是能力要求非常高,观察和分析不到位,就不能准确的表述和计算,要想此题得满分必须非常优秀才行!此题与2009年全国卷II理综第27题,及安微卷理综第28题都极为相似,有异曲同工之妙,所以对考生不陌生!
[例4](2010山东卷,28)
(14分)硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI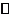 H2+I2
H2+I2
Ⅲ 2H2SO42===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是 。
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中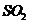 氧化性比HI强
氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1mol O2的同时产生1mol H2
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。

0~2 min内的平均放映速率v(HI)=
。该温度下,H2(g)+I2(g)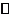 2HI(g)的平衡常数K= 。
2HI(g)的平衡常数K= 。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则 是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡 移动(填“向左”“向右”或者“不”);若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池。
已知 2H2(g)+O2(g)===2H2O(I) △H=-572KJ.mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率为 。
解析:(1)H2SO4在常温下,很稳定不易分解,这是常识,故a错;反应Ⅰ中SO2是还原剂,HI是还原产物,故还原性SO2>HI,则b错;将Ⅰ和Ⅱ分别乘以2和Ⅲ相加得:2H2O==2H2+O2,故c正确d错误。
(2) υ (H2)=0. 1mol/1L/2min=0.05 mol·L-1·min-1,则υ (HI)=2 υ (H2)=0.1 mol·L-1·min-1;
2HI(g)==H2(g)+I2(g)
2 1 1
起始浓度/mol·L-1 1 0 0
变化浓度/mol·L-1: 0.2 0.1 0.1
平衡浓度/mol·L-1: 0.8 0.1 0.1
则H2(g)+I2(g)== 2HI(g)的平衡常数K= =64mol/L。
=64mol/L。
若开始时加入HI的量是原来的2倍,则建立的平衡状态和原平衡是等比平衡,HI、H2、I2 的物质的量、平衡浓度都是原来的两倍;各组分的百分含量、体积分数相等,平衡常数相等(因为温度不变);因开始时的浓度增大了,反应速率加快,达平衡时间不可能是原来的两倍,故选b.
(3)水的电离平衡为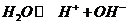 ,硫酸电离出的
,硫酸电离出的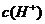 对水的电离是抑制作用,当
对水的电离是抑制作用,当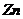 消耗了
消耗了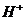 ,
,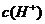 减小,水的电离平衡向右移动;若加入
减小,水的电离平衡向右移动;若加入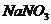 ,溶液变成
,溶液变成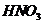 的溶液了,不再生成H2;加入的
的溶液了,不再生成H2;加入的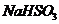 会和
会和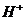 反应,降低
反应,降低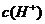 ,反应速率减慢;
,反应速率减慢;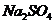 的加入对反应速率无影响;加入CuSO4 后,
的加入对反应速率无影响;加入CuSO4 后,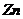 与置换出的Cu构成原电池,加快了反应速率,选b.
与置换出的Cu构成原电池,加快了反应速率,选b.
(4)根据反应方程式,生成1mol水时放出热量为:572kJ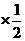 =286
kJ,故该电池的能量转化率为
=286
kJ,故该电池的能量转化率为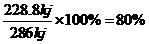
答案:(1)c
(2)0.1 mol·L-1·min-1 ;64mol/L;b
(3)向右;b
(4)80%
[例5](2010广东理综卷,31)
(16分)硼酸(H3BO3)在食品、医药领域应用广泛。
(1)请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________。
(2)在其他条件相同时,反应H3BO3 +3CH3OH B(OCH3)3
+3H2O中,H3BO 3的转化率(
B(OCH3)3
+3H2O中,H3BO 3的转化率(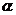 )在不同温度下随反应时间(t)的变化见图12,由此图可得出:
)在不同温度下随反应时间(t)的变化见图12,由此图可得出:
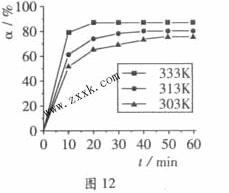
①温度对应该反应的反应速率和平衡移动的影响是____ ___
②该反应的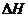 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).
(3)H3BO 3溶液中存在如下反应:
H3BO 3(aq)+H2O(l) [B(OH)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
[B(OH)4]-( aq)+H+(aq)已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
解析:(1)根据元素守恒,产物只能是H2, 故方程式为B2H6 + 6H2O=2H3BO3 +6H2。
(2)由图像可知,温度升高,H3BO 3的转化率增大,故升高温度是平衡正向移动,正反应是吸热反应,△H>O。
(3)
K=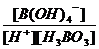 =
=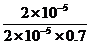 =
=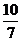
答案:
(1) B2H6 + 6H2O=2H3BO3 +6H2
(2) ①升高温度,反应速率加快,平衡正向移动 ②△H>O
(3) 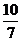 或1.43
或1.43
[巩固练习1](山东聊城三中2010届高三12月月考)在20L恒容的密闭容器中,加入3molSO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡。
(1)0min-4min内生成O2的平均速率
v(O2)=________________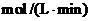
(2)整个过程中,各物质的浓度与时间关系如图所示,则该温度下的平衡常数
K=_____________________
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05mol/L的是__________,此时的平衡常数与(2)小题比较_____________(填“大于”、“小于”或“等于”)
|
|
A |
B |
C |
D |
|
SO3 |
1mol |
3mol |
3mol |
0mol |
|
SO2 |
2mol |
1.5mol |
0mol |
6mol |
|
O2 |
2mol |
1mol |
0mol |
5mol |
(4)物质的浓度不再改变标志该反应已达平衡,下列还可以说明该反应已达平衡的是_____(填序号)
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均分子量不再改变
④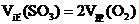
⑤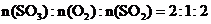
答案(1)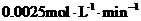
(2)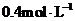
(3)BD, 等于
(4)①③④
[巩固练习2](福建省福州三中2010届高三上学期月考)2L容积不变的密闭容器中,加入1.0molA和2.2molB,进行如下反应:A(g)+2B(g) C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图
试回答下列问题:

(1)800℃时。0-5min内,以B表示的平均反应速率为 。
(2)能判断该反应达到化学平衡状态的标志是 。
A.容器压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
E. 混合气体密度不变
(3)利用图中数据计算800℃时的平衡常数K= ,B的平衡转化率为: 。该反应为 反应(填吸热或放热)。
(4)700℃时,另一2L容积不变的密闭容器中,测得某时刻各物质的量如下:n(A)=2.2mol,n(B)=5.2mol,n(C)=1.8mol,n(D)=1.8mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
答案(1)0.12mol·L-1·min-1
(2)AB(2分,漏一个扣1分,错选不得分)
(3)1.8(mol·L-1)-1(单位可不写)54.5% 吸热
(4)向正反应方向
化学反应速率和平衡的综合应用及图象单元测试
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com