
2.下列物质中含氢原子数最多的是 ( )
A. 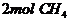 B.
B.
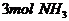 C. 4molH3PO4 D.5mol
C. 4molH3PO4 D.5mol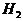
1.下列实验仪器不宜直接用来加热的是 ( )
A.试管 B.坩埚 C.蒸发皿 D.烧杯
2.外内:
(1)浓度:浓度越大,单位体积内活化分子数 ,有效碰撞的几率 ,发生化学反应的速率 ;因此,化学反应速率与浓度有密切的关系,浓度越大,化学反应速率越快。增大反应物的浓度,正反应速率加快。
(2)温度:温度越高,一方面活化分子百分数 ,另一方面含有较高能量的分子间的碰撞频率 ,两个方面都使分子间有效碰撞的几率 ,反应速率 (正逆反应速率都加快)。
(3)压强:对于有气体参与的化学反应,通过改变容器体积而使压强变化的情况(PV=nRT):压强增大,相当于浓度 ,反应速率 。(反应物和生成物的浓度都增大,正逆反应速率都增大,相反,亦然)。
(4)催化剂:使用正催化剂,反应所需的活化能 ,活化分子百分数 ,有效碰撞的几率 ,化学反应速率 (对于可逆的反应使用催化剂可以同等程度地改变正逆反应速率)。
试题枚举
[例1]已知:4NH3+5O2 4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)
[mol·L-1·min-1]表示,则关系正确的是
4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)
[mol·L-1·min-1]表示,则关系正确的是
A.4υ(NH3)=5υ(O2) B. 5υ(O2)=6υ(H2O)
C. 3υ(NH2)=2υ(H2O) D. 4υ(O2=5υ(NO)
解析:化学反应方程式的系数与分别用各物质表达的化学反应速率成正比。
答案:C、D
[变式]在2L密闭容器中,发生3A(气)+B(气)=2C(气)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol/L·s,则10秒钟后容器中B的物质的量为
A.2.8mol B.1.6mol C.3.2mol D.3.6mol
答案:C
[例2]某温度时,浓度都是1mol·L-1的两种气体,X2、Y2在密闭容器中反应生成气体Z,达到平衡时c(X2)=0.4mol·L-1、c(Y2)=0.8mol·L-1、c(Z)=0.4mol·L-1,则该反应的反应式是
A. X2+2Y2
 2XY2 B. 2X2+Y2
2XY2 B. 2X2+Y2  2X2Y
2X2Y
C. 3X2+Y2 2X3Y D. X2+3Y2
2X3Y D. X2+3Y2  2XY3
2XY3
解析:根据化学反应方程式的系数与分别用各物质表达的化学反应速率成正比的关系,只需分别计算同一时间内用各物质表达的化学反应速率,然后进行比较。
答案:C
[变式]A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1mol/L。反应进行2min后A的浓度为0.8mol/L,B的浓度为0.6mol/L,C的浓度为0.6mol/L。则2min内反应的平均速率υA=__________,υB=_____________,υC=___________。该反应的化学反应方程式为___________________________。
答案υA=0.1mol·L-1·min-1, υB=0.2mol·L-1·min-1, υC=0.3mol·L-1·min-1;
化学反应方程式为A+2B=3C。
[例3]在一定条件下,反应N2+3H2
 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
A. υ(H2)=0.03mol/(L·min) B. υ(N2)=0.02mol/(L·min)
C. υ(NH3)=0.17g/(L·min) D. υ(NH3)=0.01mol/(L·min)
解析:根据题目可知V(NH3)=0.01mol/(L·min),根据反应系数与化学反应速率的关系可求出V(H2)=0.015mol/(L·min)
答案:D
[变式]4NH3+5O2
 4NO+6H2O反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的反应速率为
4NO+6H2O反应在5L的密闭容器中进行,半分钟后,NO物质的量增加了0.3mol,则此反应的反应速率为
A.υ(O2)=0.01mol/L·s B.υ(NO)=0.008mol/L·s
C.υ(H2O)=0.003mol/L·s D.υ(NH3)=0.002mol/L·s
答案:CD
[变式]把0.6molX气体和0.4molY气体混合2L于容器中使它们发生如下反应,3X(气)+Y(气) nZ(气)+2W(气),5min末已生成0.2mol W,若测知以Z浓度变化来表示的反应平均速率为0.01mol/L·min,则
(1)上述反应中Z气体的反应方程式系数n的值是
A.1 B.2 C.3 D.4
(2)上述反应在5分钟末时,已消耗的Y值占原来的分数是
A.20% B.25% C.33% D.50%
答案:(1)A (2)B
[例4]下列体系加压后,对化学反应速率没有影响的是
A.2SO2+O2
 2SO3 B.CO+H2O(气)
2SO3 B.CO+H2O(气)  CO2+H2
CO2+H2
C.CO2+H2
 H2CO3 D.OH-+H+=H2O
H2CO3 D.OH-+H+=H2O
解析:压强对没有气体参加的反应无影响。
答案:D
[例5]把镁带投入盛有盐酸的敞口容器里,在下列因素中:①盐酸的浓度,②镁带的表面积,③溶液的温度,④氯离子的浓度。对反应速率有影响的是
A.①② B.③④ C.①②③④ D.①②③
解析:根据影响反应速率的因素有:浓度、温度、压强和催化剂可知,①③肯定对反应速率有影响,而镁带的表面积越大则与盐酸的接触越充分,显然反应速率越快。此反应的实质是Mg+2H+=Mg2++H2↑,与氯离子浓度无关,所以④对此反应速率无影响。故本题的正确答案为D。
答案:D
1.内因: (如:钠与水反应和钾与水反应速率明显不同)。
3.相互关系:
4NH3+5O2 4NO+6H2O(g)
4NO+6H2O(g)
υ(NH3)∶υ(O2)∶υ(NO)∶υ(H2O)=4∶5∶4∶6
2.单位:mol/(L·s);mol/(L·min);mol/L·S。
用单位时间里反应物浓度的减少或生成物浓度的增加来表示。
1.表示方法:υ=△c/△t
43.材料一: 我国02-08年CPI走势图
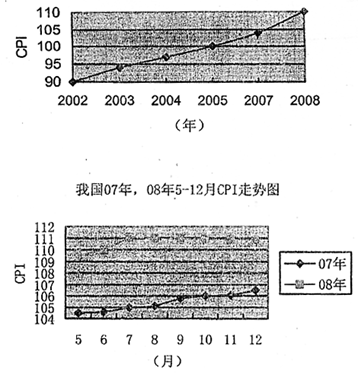
注:CPI(即居民消费物价指数),国际上反映居民家庭所购买的消费商品和服务价格水平变动情况的指标,并用它来反映通货膨胀程度。上述两张图表,以2005年CPI指数为100(%)
材料二:我国2008年12月的CPI比11月回落1.2%,2009年1、2月份,居民作废价格总水平同比继续下降,预计今年一季度CPI将同比去年第四季度下降1.0%。2008年12月8日至10日在北京举行的中央经济工作会议指出,在国际金融危机肆虐和国内经济增速下滑的大背景下,“保增长、促发展”成为2009年中央经济工作会议的主题。
(1)材料一的二张图表分别反映了哪些经济信息?(5分)
(2)针对去年前三季度较高的通货膨胀压力,我国政府采取哪些经济手段进行干预和调节。(2分)
(3)去年第四季度以来CPI同比下降和国内经济增速下滑,可能对今后一段时期经济运行和人民生活产生怎样的不利影响?(6分)
(4)你认为国家可以采取什么具体的财政政策措施来控制CPI指数的进一步走低?(2分,两条以上)
42.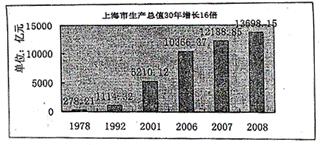 材料一:
材料一:
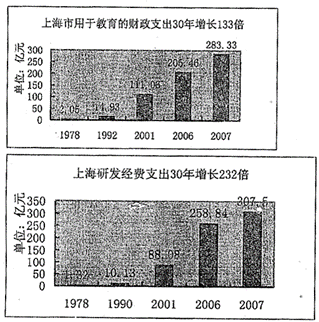 材料二:
材料二:
注:全社会研究和开发(R&D)支出水平是国家科技实力比较的一个重要指标。
材料三:
|
近年来上海获奖国家科技奖数量 |
|||||||
|
年度 |
2002 |
2003 |
2004 |
2005 |
2006 |
2007 |
2008 |
|
获奖数 |
31 |
26 |
42 |
46 |
42 |
54 |
57 |
|
占全国比重 |
11.8% |
10.2% |
14% |
14.3% |
12.9% |
15.4% |
16.4% |
(1)从材料二中可以看出,改革开放30年来,上海的教育和研发经费支出增长很快。请问国家的财政收入和财政支出的分配,是通过什么实现的?(2分)
(2)近年来,党和国家每年隆重举行国家科学技术奖励大会,重奖为我国科学技术事业作出突出贡献的科技工作者。请问重奖作出贡献的科技工作者,体现经济常识的什么知识?(3分)
(3)运用经济常识有关知识,将上述材料一、二、三联系起来加以分析说明。(8分)
(4)温家宝总理在2009年国家科学技术奖励大会上指出:“要坚持科教兴国战略,把提高自主创新能力,建设创新型国家作为国家发展战略的核心。”你认为我国当前科技创 新的重点任务是什么?请列举其中的一条,或者提一个建议。(2分)
41.国务院总理温家宝2009年1月7日主持召开国务院常务会议,部署做好高校毕业生就业工作。会议指出,面对当前国际金融危机蔓延、我国就业形势十分严峻的情况,必须把高校毕业生就业摆在就业工作的首位。
(1)会议提出了加强高校毕业生就业工作的七项措施,从多种途径引导高校毕业生就业。请问就业的途径包括哪些方面?(2分)
(2)国务院提出的七项措施中,有一项是鼓励毕业生到非公有制企业就业。请运用我国基本经济制度的有关知识,简要回答鼓励毕业生到非公有制企业就业的必要性。(4分)
(3)国务院提出的七项措施中,还有一项是鼓励和支持毕业生自主创业。请运用所学经济常识简要回答创业所需要具备哪些主观和客观条件?(4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com