
2、(广东省中山一中2009届高三第二次统测化学试题)(12分)已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质。

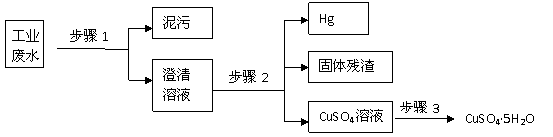
(1)步骤1的主要操作是 ,需用到的玻璃仪器除烧杯外有 。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,
固体残渣的成分是(填化学式) 。
(3)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是
答案、(12分)(1)过滤(2分), 漏斗、玻璃棒(各1分,共2分)
(2)Cu(2分), Ag、Cu(各1分,共2分)
(3)冷却结晶(2分)(4)因为Hg有挥发性,且有毒。(2分)
1、(广东省中山一中2009届高三第二次统测化学试题)(13分)海水中蕴藏着丰富的资源。海水综合利用的流程图如下。

(1)用NaCl做原料可以得到多种产品。
① 工业上由NaCl制备金属钠的化学方程式是__________________ _____________。
② 实验室用惰性电极电解100 mL0.1 mol/LNaCl溶液,若阴阳两极均得到112 mL气体(标准状况),则所得溶液的pH为______ ___(忽略反应前后溶液的体积变化)。
③ 电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:_________ ___________________。
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。
 ① 粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去。Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。若只加一种上述(1)中得到的产品,该物质的化学式为_______________,控制溶液的pH为____________________。
① 粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+,需将Fe2+、Fe3+、Mn2+转化为沉淀除去。Fe(OH)2呈絮状,常将其转化为Fe(OH)3而除去(生成氢氧化物沉淀的pH见表)。若只加一种上述(1)中得到的产品,该物质的化学式为_______________,控制溶液的pH为____________________。
② 在家用电热水器不锈钢内胆表面镶嵌镁棒,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:____________________________________________。
答案(1) ① 2NaCl(熔) 2Na+Cl2↑
(2分)
② 13 (3分)
③ NaCl+H2O
2Na+Cl2↑
(2分)
② 13 (3分)
③ NaCl+H2O  NaClO+H2↑(2分)
NaClO+H2↑(2分)
(2) ① NaClO(2分); 9.8(2分) ② O2+2H2O+4e- = 4OH-(2分)
3.对于化学平衡的有关图象问题,可按以下的方法进行分析:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒沙特列原理挂钩。
(2)紧扣可逆反应的特征,搞清正反应方向是吸热还是放热,体积增大还是减小、不变,有无固体、纯液体物质参加或生成等。
(3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。
(4)看清起点、拐点、终点,看清曲线的变化趋势。
(5)先拐先平。例如,在转化率-时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
(6)定一议二。当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系。
 试题枚举
试题枚举
[例1]某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图1所示,则该反应的化学方程式为_________,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。
解析:这类题目是讨论同一时间段内各物质的变化量的比例关系,且要注意物质的量减少的为反应物,物质的量增多的为生成物。又因物质的量都不变时,反应物、生成物共存,故方程式要用“ ”表示。
”表示。
答案:2A 3B+C;0.08mol/(L·s);0.12mol/(L·s)。
3B+C;0.08mol/(L·s);0.12mol/(L·s)。
[例2] 对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为
 A.Z、W均为气体,X、Y中有一种是气体
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
解析: 经常有一些同学错选B,认为增大压强,平衡向气体体积缩小的方向移动.其实,图象告诉我们的是:增大压强,加快了正、逆反应,但逆反应速率增大的幅度大于正反应速率增大的幅度,由此而导致平衡向左移动.而压强的改变,只影响气体反应的速率,选项B所言的X、Y皆非气体即其正反应速率不受影响,故正确答案为A.
答案:A
[例3]下列各图是温度(或压强)对应 ;
; 的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是
的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是

解析:曲线交点表示建立平衡时的温度或压强,升高温度,增加压强, 、
、 均增大,B中
均增大,B中 ,D中
,D中 、
、 走向均减小,则B、D均错;可逆反应
走向均减小,则B、D均错;可逆反应 ;
; 的正反应是一个气体体积增大的吸热反应,则升高温度,向正反应方向移动,故
的正反应是一个气体体积增大的吸热反应,则升高温度,向正反应方向移动,故 ;增加压强,向逆反应方向移动,故
;增加压强,向逆反应方向移动,故 。
。
答案:A、C
[例4] 现有可逆反应A(g)+2B(g) nC(g)+Q,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是 [ ].
nC(g)+Q,在相同温度、不同压强时,A的转化率跟反应时间(t)的关系如图4,其中结论正确的是 [ ].
A.p1>p2,n>3 B.p1<p2,n>3
C.p1<p2,n<3 D.p1>p2,n=3
解析: 当其他条件不变时,对于有气体参加的可逆反应,压强越大,到达平衡的时间越短.图象中曲线和横轴平行,表明反应已达平衡.由图象知道,当压强为p2时,该反应到达平衡的时间较短,故p1<p2.在其他条件不变的情况下,增大压强会使化学平衡向着气体体积缩小的方向移动.因p1<p2,且当压强为p1时,A的转化率较大,所以正反应为气体体积增加的反应,即1+2<n,故正确答案选B。
答案:B
2.对于化学反应速率的有关图象问题,可按以下的方法进行分析:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与有关的原理挂钩。
(2)看清起点,分清反应物、生成物,浓度减小的是反应物,浓度增大的是生成物一般生成物多数以原点为起点。
(3)抓住变化趋势,分清正、逆反应,吸、放热反应。升高温度时,v(吸)>v(放),在速率-时间图上,要注意看清曲线是连续的还是跳跃的,分清渐变和突变,大变和小变。例如,升高温度,v(吸)大增,v(放)小增,增大反应物浓度,v(正)突变,v(逆)渐变。
(4)注意终点。例如在浓度-时间图上,一定要看清终点时反应物的消耗量、生成物的增加量,并结合有关原理进行推理判断。
1.牢固掌握有关的概念与原理,尤其要注意外界条件的改变对一个可逆反应来讲,正逆反应速率如何变化,化学平衡如何移动,在速度-时间图、转化率-时间图、反应物的含量-浓度图等上如何体现。要能够画出有关的变化图象。
2.能够通过对图形、图表的观察,获取有关的感性知识和印象,并对这些感性知识进行初步加工和记忆
知识梳理
1.进一步掌握理解浓度、温度、压强、催化剂等条件对化学反应速率和化学平衡移动的影响。
(一) (二)
现测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如上图(二)所示。
己知。A分子中只含一个苯环,且苯环上只有一个取代基,试填空。
(1)A的分子式为 。
(2)A的结构简式为 。
(3)A的芳香类同分异构体有多种,请按要求写出其中两种结构简式:
①分子中不含甲基的芳香酸: 。
②遇FeCl3显紫色且苯环上只有两个取代基的芳香醛: 。
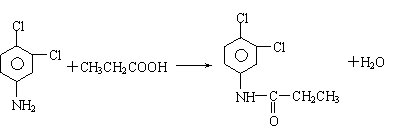
19、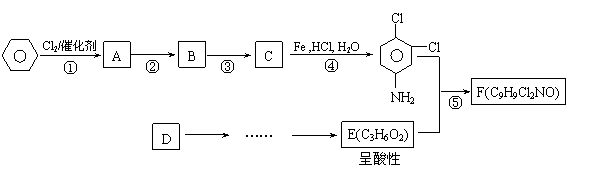 (10分)有机物F商品名称“敌稗(Propanil)”,是一种优良的水稻除草剂,现通过下列合成路线,以有机苯和一种烃为原料制备:
(10分)有机物F商品名称“敌稗(Propanil)”,是一种优良的水稻除草剂,现通过下列合成路线,以有机苯和一种烃为原料制备:

Ⅰ.已知: (X表示卤素原子,下同)
Ⅱ.
Ⅲ.当一取代苯继续发生取代反应时,新引进的取代基受到原取代基的影响而取代邻位、对位或间位。使新的取代基进入它的邻位、对位的取代基:-CH3、-NH2、-X;使新的取代基进入它的间位的取代基有:-COOH、-NO2等。
请结合上述所给信息,回答问题:
(1)写出结构简式:B D:
(2)有人认为:若将②、③两步反应顺序颠倒,也可以得到C,实际上是不妥的。请你指出不妥之处 。
(3)写出下列反应类型:反应① 、 反应④ 。
(4)反应⑤的化学反应方程式: 。

20、(12分)生产工程塑料PBT ( ) 的重要原料G(1,
4-丁二醇),可以通过下图三种不同的合成路线制备。已知A为乙炔,B的所有原子均处于同一平面上。
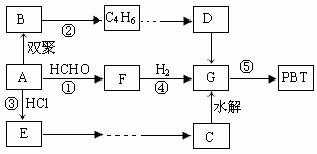
请结合下列所给信息,回答有关问题:
I.2R-Cl + 2Na 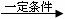 R-R + 2NaCl
R-R + 2NaCl
II.R1-C≡C-H+R2-CHO 
 (R代表不同烃基或H)
(R代表不同烃基或H)
III.R-C≡C-(CH2)n-CH=CH2+H2 R-CH=CH-(CH2)n-CH=CH2(n≥0)
R-CH=CH-(CH2)n-CH=CH2(n≥0)
(1)结构简式: F为 _______。在①~⑤的反应中属于加成反应有 。
(2)反应⑤的化学反应方程式为: 。
(3)写出由E为原料合成一种塑料的反应方程式 。
(4)请设计出自E→…→G的反应流程图(有机物用结构简式表示,应注明反应条件)。
提示:①合成过程中无机试剂任选 ②反应流程图表示方法示例如下:

21、 (10分)双烯合成也称狄尔斯-阿德耳(Diels-Alder)反应,他们因此获得1950年的诺贝尔化学奖。如:
(10分)双烯合成也称狄尔斯-阿德耳(Diels-Alder)反应,他们因此获得1950年的诺贝尔化学奖。如:
试回答下列问题:
 (1)从现代化学观点看,“Diels-Alder反应”的优点是 。
(1)从现代化学观点看,“Diels-Alder反应”的优点是 。
(2)已知:① CH3CH=CHCH2CH3 CH3COOH+CH3CH2COOH
 ②
② 
③ RCH2CH=CH2+Cl2 RCHClCH=CH2+HCl
有机物
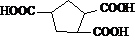 可由烃A和酯B按下列路线合成:
可由烃A和酯B按下列路线合成:
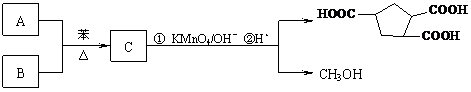
① A与B反应生成C的化学方程式 。
② B(只含有一个碳碳双键)在RuCl作催化剂下,可由一种酯和一种炔直接加成得到,则该酯和炔结构简式分别为 和 。
③ 请用反应流程图表示以2-甲基-1,3-丁二烯、丙烯和苯合成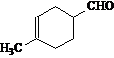 的过程。
的过程。
22、(7分)某有机化合物A的相对分子质量(分子量)大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
(1)该化合物分子中含有几个氧原子,为什么?
(2)该化合物的相对分子质量(分子量)是 。
(3)该化合物的化学式(分子式)是 。
(4)该化合物分子中最多含 个 官能团。
官能团。
太仓高级中学2009届高三化学烃单元验收试题答案及评分标准
第Ⅰ卷(选择题,共48分)
选择题答案表:(1-8题每题3分,9-16题每题4分)
第Ⅱ卷(非选择题,共72分)
15、(5分)
⑴将试剂瓶放在热水中加热,待苯融化后再向容器中倾倒。 (2分)
⑵ B、C、D、F、G、H (3分)
16、(12分)
(1)Mg(ClO4)2固体(2分)
(2)Mg(ClO4)2,CuSO4,碱石灰(各1分)
通入气体要缓慢,所用吸收剂要过量(2分)
(3)D装置后再装一个盛有碱石灰的干燥管(2分)
(4)增大氧气的量、燃烧后的气体通过灼热的CuO(2分)
(5)称量准确(1分)
17、(8分)
(1) (2分) 。
(2分) 。
(2)① a b (2分) ; 3 (1分) , 2(1分) 。 ②3 种。(2分)
18、(8分)(1)C9H10O2
(2)C6H5COOCH2CH3
(3)C6H5CH2CH2COOH HOC6H4CH2CH2CHO
19、(10分) (1)B: (2分),D:CH2=CH2(2分)
(2分),D:CH2=CH2(2分)
(2)所得C的纯度不高 (2分)
(3)取代、还原(2分)
(4)
(2分)
20、(12分)

21、(10分) (1)原子利用率100%,符合绿色化学理念···················(2分)
(2) ① 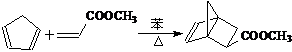 ·················(2分)
·················(2分)
② HCOOCH3 CH≡CH················ (写对1个得1分,共2分)
(3) (4分)
(4分)
22、(7分)(1)4个(4分);(2)134(1分) (3)C5H10O4 (1分) (4)1(1分)
解析:本题考查根据相对分子质量的大致范围、元素的质量分数确定有机物中的原子个数和物质组成,并由物质组成推测可能的物质结构。
(1)A中O的质量分数为1-52.24%=47.76%。
若A的相对分子质量为110,其中O原子个数为:= 3.2835;
若A的相对分子质量为150,其中O原子个数为:= 4.4775。
实际的O原子个数应为介于3.2835和4.4775之间的整数,所以为4。
(2)A的相对分子质量为:= 134。
(3)A中C、H的相对原子质量之和为134×52.24%=70,由有机物中C、H原子间的关系,只可能是5个C、10个H,所以A的分子式为C5H10O4。
(4)与饱和烃的含氧衍生物(CnH2n+2Ox)相比,A的分子中少了2个H原子,所以最多含一个C O。
9、2-氨基-5-硝基苯甲醚俗称红色基B,主要用于棉纤维织物的染色,也用于制金黄、枣红、黑等有机颜料,其结构简式如右图。若分子式与红色基B相同,且氨基(-NH2)与硝基(-NO2)直接连在苯环上并呈对位时的同分异构体数目(包括红色基B)可能有( )
A、2种 B、4种 C、6种 D、10种
10、下列化合物中的所有碳原子可能都在同一平面上的是( )


A、 B、
C、CH2=CHCH=CH2 D、(CH3)3C-C≡C-CH=CHCH3
11、化学工作者把烷烃、烯烃、环烷烃、炔烃的通式转化成键数的通式,给研究有机物分子中键能大小的规律带来了很大的方便。设键数为I,则烷烃中碳原子跟键数关系的通式为CnI3n+1,则苯(视为单双键交替,双键视为两个单键)的同系物中碳原子跟键数关系的通式为( )
A、CnI3n-1 B、CnI3n-2 C、CnI3n-3 D、CnI3n-4
12、X、Y两种有机物的分子式不同,但均含有C、H或C、H、O,将X、Y以任意比例混合,只要物质的量之和不变,完全燃烧时的耗氧量和生成水的物质的量也分别不变.则下列有关判断正确的是( )
A.X、Y分子式中氢原子数一定要相同,与碳原子数的多少无关
B.若X为CH4,则相对分子质量最小的Y是甲醇
C.若X为CH4,则相对分子质量最小的Y是乙二醇
D.X、Y的化学式应含有相同的氢原子数,且相差n个碳原子,同时相差2n个氧原子(n为正整数)
13、 在有机物的分子中,当一个碳原子上连接4个不同的原子或者原子团时,该碳原子被称为“手性碳原子”,在碳原子上用“*”标记,凡具有一个手性碳原子的物质一定具有光学活性,如图所示的有机物含有一个手性碳原子,具有光学活性,当发生下列反应时。生成的新化合物无光学活性的是( )
在有机物的分子中,当一个碳原子上连接4个不同的原子或者原子团时,该碳原子被称为“手性碳原子”,在碳原子上用“*”标记,凡具有一个手性碳原子的物质一定具有光学活性,如图所示的有机物含有一个手性碳原子,具有光学活性,当发生下列反应时。生成的新化合物无光学活性的是( )
A、与NaOH溶液共热 B、与氢气发生加成反应
C、与甲酸在一定条件下发生酯化反应 D、与新制银氨溶液共热反应
14、乙烯酮(CH2=C=O)在一定条件下,能与含活泼氢的化合物发生如下加成
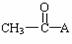
反应:CH2=C=O+HA→ 乙烯酮在一定条件下与下列试剂加成,其中产物不正确的是( )
A.与HCl加成: ; B.与CH3COOH加成:
; B.与CH3COOH加成: ;
;

C.与H2O加成: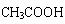 ; D.与CH3CH2OH加成:
; D.与CH3CH2OH加成:
选择题答题表:
第Ⅱ卷(非选择题,共72分)
15、(5分) (1)(2分)苯(熔点5.5℃)在室温较低时,就会凝结成像无色晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出苯。答:
。
(2)(3分) 下列说法中,不正确的是____________。(多选倒扣分)
A.实验室制乙烯时,在酒精和浓硫酸的混合液中,放入几片碎瓷片,加热混合物,使液体温度迅速升到170℃
B.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置,待液体分层后,滴加硝酸银溶液
C.苯与溴水在铁粉的催化作用下制备溴苯
D.验证蔗糖水解产物时,在蔗糖溶液中加几滴稀硫酸,水浴5min,加入新制银氨溶液
E.向2mLl0%NaOH溶液中滴入2%CuSO4溶液的4-6滴,振荡后加入乙醛溶液0.5 mL,加热至沸腾,则有红色沉淀出现
F.实验室中进行的下列实验需水浴加热:①乙酸乙酯的制备②葡萄糖的银镜反应
G.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂
H.证明CH3CH2CH=CHCH2CHO分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色
16、(12分) 烃的分子式的确定是有机物研究的一个重点。烃分子式的确定一般需要两个条件,其一为烃的相对分子质量,其二为烃中各元素的质量分数或元素的质量比。所以准确测定烃中碳、氢元素的质量分数,是确定烃的分子式的关键之一。为此,某化学研究小组以“烃类有机物中碳、氢元素的质量分数测定”为题进行了如下的实验设计。
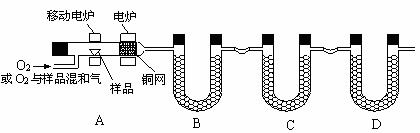
一定量样品和氧气混合气经过灼热的铜网时被充分氧化,产生二氧化碳和水蒸气。经B、C装置可以测得产生的二氧化碳和水蒸气的质量,进而推知样品中碳和氢元素的质量分数。 (1)产生的二氧化碳和水蒸气是否被充分吸收,会影响碳、氢元素的含量测定。研究小组的成员查找到了下列有关数据,试图了解吸收剂的吸收性能。下表是20℃时,1m3空气中经下列吸收剂吸收后水蒸气残留的克数:
|
吸收剂 |
浓硫酸 |
Mg(ClO4)2固 |
CuSO4 |
硅胶 |
CaO |
NaOH |
|
残留质量 |
0.003 |
0.0005 |
1.4 |
0.03 |
0.2 |
0.14-0.25 |
根据上述数据,你认为吸收水蒸气时,最理想的吸收剂是 。
(2)你认为研究小组在这一实验中,B中的药品为 ,C中的药品为 ,D中药品为 。要使二氧
化碳和水蒸气充分吸收,可采取的措施有(至少写两条)
。
(3)为了减少对测定二氧化碳质量的影响,你认为在本装置中还应改进的是
。
(4)混合气体是否能充分燃烧,也将直接影响测定的结果。为了使混合气体充分燃烧,研究小组想了许多办法,你认为可能是 。
(5)要完成该课题,除了要考虑样品的充分燃烧和产物的充分吸收外,你认为至少还要注意哪一条关键? 。
17、(8分) 人们对苯及芳香烃的认识有一个不断深化的过程。
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出分子式为 C6H6 的一种含两个叁键且无支链的链烃的结构简式 ________ 。
 (2)已知分子式为 C6H6 的结构有多种,
(2)已知分子式为 C6H6 的结构有多种,
其中的两种为:
① 这两种结构的区别表现在:
定性方面(即化学性质方面):Ⅱ能__ _____(选填a、b、c、d,多选扣分)而Ⅰ不能。
a、被酸性高锰酸钾溶液氧化 b、能与溴水发生加成反应,
c、能与溴发生取代反应 d、能与氢气发生加成反应
定量方面(即消耗反应物的量的方面):1 mol C6H6 与H2加成时:
 Ⅰ需____ __mol,而Ⅱ 需 ___ ____mol。
Ⅰ需____ __mol,而Ⅱ 需 ___ ____mol。
② 今发现 C6H6 还可能有另一种如右图立体结构,该结构的二氯代物有_______种。
18、(8分)化合物A经李比希法测得其中含c 72.0%、H 6.67%,其余含有氧,质谱法分析得知A的相对分予质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。

 方法一:核磁共振仪可以测定有机分子里不同化学环境的氢原子及其相对数量。如乙醇(CH3CH2OH)的核磁共振氢谱有3个峰,其面积之比3:2:1,见下图(一)所示。
方法一:核磁共振仪可以测定有机分子里不同化学环境的氢原子及其相对数量。如乙醇(CH3CH2OH)的核磁共振氢谱有3个峰,其面积之比3:2:1,见下图(一)所示。
8、由  和CH3COOH(其它原料自选)制取
和CH3COOH(其它原料自选)制取 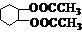 ,依次发生的反应是(
)
,依次发生的反应是(
)
A、取代→加成→消去→加成→取代→酯化
B、加成→消去→取代→加成→取代→酯化
C、取代→消去→加成→取代→酯化→加成
D、氯代→加成→硝化→加成→水解→酯化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com