
2.反应:A(气)+3B(气)?2C(气)放热达平衡后,将气体混合物的温度降低,下列叙述正确的是
A.正反应速率增大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率增大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都变小, 平衡向正反应方向移动
D.正反应速率和逆反应速率都变小, 平衡向逆反应方向移动
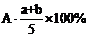
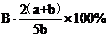
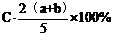
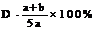 3.A、B、c为三种气体,把a molA和b molB充入一密闭容器中,发生反应A+2B
3.A、B、c为三种气体,把a molA和b molB充入一密闭容器中,发生反应A+2B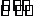 2C达到平衡时,若它们的物质的量满足n(A)+n(B)=n(C),则A的转化率为 ( )
2C达到平衡时,若它们的物质的量满足n(A)+n(B)=n(C),则A的转化率为 ( )
1.使反应4NH3(g)+3O2(g)=2N2(g)+6H20(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了O.6mol。此反应的平均速率v(X)为 ( )
A. v(NH3)=0.02mol·L-1·s-1 B. v(O2)=0.015mol·L-1·s-1
C. v(N2)=0.02mol·L-1·s-1 D. v(H2O)=0.02mol·L-1·s-1
10.(惠州市2009届高三第一次调研 ) (12分)某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl3中的一种或几种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标况下的体积):

请回答:
(1)混合物中是否存在FeCl2 (填“是”或“否”); ,
(2)混合物中是否存在(NH4)2SO4 (填“是”或“否”),你的判断依据是_______。
(3)写出反应⑤的离子反应方程式; 。
(4)请根据图中数据分析,原固体混合物中一定含有的物质为 (写化学式),不写计算过程。
(5)把AlCl3溶液加热浓缩蒸干,不能得到较纯的A1Cl3晶体,请你设计一个可行的简易实验从溶液中得到较纯的AlCl3结晶: 。
 答案.(12分)(1)否(2分) (2)是(2分)气体通过浓硫酸减少4.48L(1分)
答案.(12分)(1)否(2分) (2)是(2分)气体通过浓硫酸减少4.48L(1分)
(3)A1(OH)3++3H+=A13++3H2O(2分)
(4)一定含有A1、(NH4)2SO4和MgCl2三种物质(3分)
(5)往氯化铝溶液中加入一定量的浓盐酸后,再加热浓缩析出晶体。(2分
9.(惠州市2009届高三第一次调研 ) (13分)短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素。A、C同主族,B的最外层电子数为次外层的3倍.B、C的最外层电子数之和与D的最外层电子数相
 等。
等。
⑴D的最高价氧化物对应水化物的名称为__________________________。
⑵C2B2的电子式为 ,其中含有的化学键类型为 。
⑶由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分。请写出引起该盐溶液呈碱性原因的离子反应方程式_____________________________________。
⑷用石墨电极电解CD的饱和溶液,反应的离子方程式为 。
⑸实验室欲检验CD溶液中所含的D一,操作方法和现象为 。
答案(1)高氯酸(2分) (2分) (2)离子键和非极性
共价键(或离子键和共价键)(2分,只答一种不给分)
(3)ClO-+H2O HCIO+OH-(2分)
HCIO+OH-(2分)
(4)2C1-+2H2O Cl2↑+H2↑+2OH-(2分)(2分)
Cl2↑+H2↑+2OH-(2分)(2分)
(5)取适量NaCl溶液置于试管中,向其中滴入少量稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则证明有Cl-(3分)
8. (惠州市2009届高三第一次调研 )某工厂用CaSO4、H2O、NH3、CO2制备(NH4)2SO4,其工艺流程如下:
(惠州市2009届高三第一次调研 )某工厂用CaSO4、H2O、NH3、CO2制备(NH4)2SO4,其工艺流程如下:
下列推断不合理的是
A.往甲中通入CO2有利于(NH4)2SO4的生成
B.生成lmol(NH4)2SO4至少消耗2mol NH3
C.可采用加热蒸干的方法从滤液中提取(NH4)2SO4晶体
D.CaCO3煅烧所得的CO2可以循环使用
7.(惠州市2009届高三第二次调研考试 ) (16分)工业“从海水中提取镁”的流程图如下:
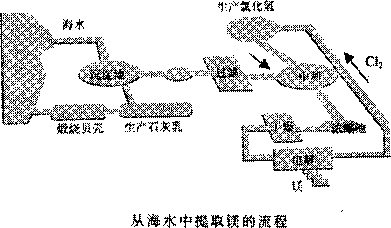
步骤为:
①将海边大量的贝壳煅烧成生石灰,并将生石灰制成石灰乳;
②将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
③在Mg(OH)2沉淀中加入盐酸得到MgCI2溶液,再经蒸发结晶得到MgCl2·6H2O;
④将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
 ⑤电解熔融的氯化镁可得到Mg。
⑤电解熔融的氯化镁可得到Mg。
⑴步骤①中涉及的化学方程式为 _______________________________________。
⑵步骤③中的蒸发利用风吹日晒完成,但在实验室中蒸发操作时需要的主要仪器有________、_________、酒精灯、三角架等。
⑶海水中的镁以Mg抖形式存在,设计步骤②③将Mg2+转化为Mg(OH)2又重新转化为Mg2+的目的是__________________。
⑷步骤④中的“一定条件”指的是_________,目的是_______________________。
⑸上述流程中,在降低成本、减少污染方面做了一些工作,请写出其中一点:
⑹有同学认为:可以在步骤②后加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,以简化实验步骤,体现实验的简约性原则。你是否同意该同学的观点________(填“同意”或“不同意”),理由为__________________________________________________。
答案.(16分)(1)CaCO3 CaO+CO2↑(2分);CaO+H2O=Ca(OH)2(2分)
CaO+CO2↑(2分);CaO+H2O=Ca(OH)2(2分)
(2)蒸发皿,玻璃棒(2分) (3)提高Mg2+的浓度,起到富集的作用(2分)
(4)在HCl气流中,(1分)抑制MgCl2水解成Mg(OH)2;带走水蒸气;(2分)
(5)电解产生的Cl2用于制取HCl气体;(2分)
(6)不同意(1分);因为MgO熔点很高,熔融时耗费大量的能量增加生产成本(2分)
6、(广东漳州市芗城中学高三年10月考)(9分)5·12汶川大地震后在灾区使用了多种消毒剂,高锰酸钾是其中之一。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
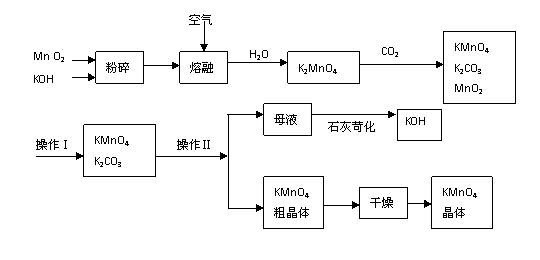

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是______(填代号)。
A.84消毒液(NaClO溶液) B.双氧水 C.苯酚 D.75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
A.浓硝酸 B.硝酸银 C.氯水 D.纯碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
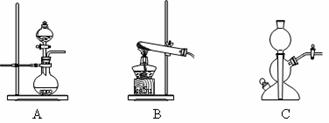
(4)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
A.石灰石 B.稀HCl C.稀H2SO4 D.纯碱
所需气体发生装置是_____________(选填代号)。

(5)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上的差异,采用__________________(填实验操作步骤)、趁热过滤得到KMnO4粗晶体的。
答案(1)AB(各1分)
(2)D;
(3)MnO2 KOH;
(4)CD A;
(5)过滤 溶解度 浓缩结晶(少“浓缩”不给分)。
5.(广东省南宫中学2009届高三9月份月考 ) (12分)A、B、C三种物质均属于同一种金属的化合物.用铂丝蘸取A、B、C三种物质的溶液,在无色火焰上灼烧,均呈浅紫色.已知:A与B反应生成C;加热B得到 D;D与A的水溶液反应生成B或生成C;B可与酸和碱反应;D是一种无色、无味的气体.
(1)A是 ,B是 ,
C是 ,D是 .
(2)写出下列反应的离子方程式: :
A+B
B+HCl
A-B
A-C
答案 (1)A是 KOH ,B是KHCO3 C是 K2CO3 ,D是 CO2 .
(2)写出下列反应的离子方程式: :
A+B OH-+HCO3-=CO32-+H2O B+HCl CO2 +H+= CO2+ H2O
A-B CO2+OH-= HCO3- A-C CO2 +2OH-= CO32-+H2O
4.(广东省汕头金山中学2009届高三化学期中考试)(11分)A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、 Ba2+、Al3+、Na+、Ag+和阴离子NO3-、OH-、SO42-、Cl-、CO32-中的各一种组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1mol/L A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
(1)根据以上事实推断A-E的化学式:
A 、B 、C 、D 、E
 (2)写出②、③、④的离子方程式:
(2)写出②、③、④的离子方程式:
②
③
④
答案(11分)A、Na2CO3 B、AgNO3 C、Fe2(SO4)3 D、AlCl3 E、Ba(OH)2(各1分)
Ag+ +2NH3.H2O=[Ag(NH3)2]++2H2O;Fe+2Fe3+= 3Fe2+;Al3++4OH-=AlO2-+2H2O(各2分)
3.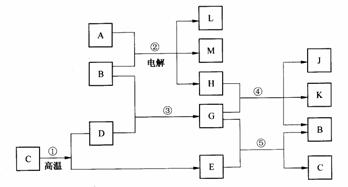 (广东省中山一中2009届高三第二次统测化学试题) (10分)根据下列反应框图填空。已知反应④是工业生产漂白粉的反应,反应⑤是实验室鉴定化合物E的方法。
(广东省中山一中2009届高三第二次统测化学试题) (10分)根据下列反应框图填空。已知反应④是工业生产漂白粉的反应,反应⑤是实验室鉴定化合物E的方法。
(1)单质L是 .
(2)化合物B是
(3)图中除反应①以外,还有两个用于工业生产的反应,是 和 。
它们的化学反应方程式是 和
。
答案(1)H2 (2分) (2) H2O (2分) (3)②④(2分)
( 方程式各2分)
2NaCl+2H2O  2NaOH+H2↑+Cl 2↑
2NaOH+H2↑+Cl 2↑
2Ca(OH)2 +2Cl 2 = Ca(ClO)2+2H2O +CaCl2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com