
2005全国1卷
已知Q与R的摩尔质量之比为9︰22,在反应X+2Y=2Q+R中,当1.6g X与Y完全反应后,生成4.4g R,则参与反应的Y和生成物Q的质量比为
A 23︰9 B 32︰9 C 46︰9 D 16︰9
2005全国2卷
NA代表阿伏加德常数,下列说法正确的是
A 在同温同压时,相同体积的任何气体单质所含的原子数目相同
B 2g氢气所含原子数目为NA
C 在常温常压下,11.2L氮气所含的原子数目为NA
D 17g氨气所含电子数目为10NA
2005全国3卷
在273K和101kPa的条件下,将2.00g氦气、1.40g氮气和1.60g氧气混合,该混合气体的体积是
A 6.72L B 7.84L C 10.08L D 13.44L
2005北京卷
下列说法正确的是
A 含有相同氧原子数的SO2和CO的质量相等
B 等物质的量浓度的NaOH溶液与氨水中的c(OH-) 相等
C 乙酸分子与甲酸甲酯分子中的共价健数相等
D 等温等压下,3mol C2H2(g)和1mol C6H6(g)的密度相等
2006全国1卷
用NA代表阿伏加德罗常数,下列说法正确的是:
A.0.5mol Al与足量盐酸反应转移电子数为1NA
B.标准状况下,11.2L SO3所含的分子数为0.5NA
C.0.1molCH4所含的电子数为1NA
D.46g NO2和N2O4的混合物所含的分子数为1NA
2006全国1卷
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为:A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
2006全国2卷
某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数为5.1%,300mL该溶液中Cl-离子的物质的量约等于
A 0.37mol B 0.63mol C 0.74mol D 1.5mol
2006北京卷
下列说法正确的是
A 200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-离子总数为6.02×1023
B 标准状况下,22.4L Cl2和HCl的混合气体中含分子总数为2×6.02×1023
C
0.1mol 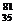 Br原子中含中子数为3.5×6.02×1023
Br原子中含中子数为3.5×6.02×1023
D 30g甲醛中含共用电子对总数为4×6.02×1023
2006重庆卷
设NA代表阿伏加德罗常数,下列说法正确的是
A 5.6g铁与足量盐酸反应转移的电子数为0.3NA
B 100mL 2.0mol/L的盐酸与醋酸溶液中氢离子数均为0.2NA
C 标准状况下,22.4L氦气与22.4L氟气所含原子数均为2NA
D 20g重水(D2O)中含有的电子数为10NA
2006四川卷
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是
A 两种气体的压强相等 B O2比O3质量小
C 两种气体的分子数目相等 D 两种气体的氧原子数目相等
2006广东卷
下列条件下,两瓶气体所含原子数一定相等的是(双选)
A 同质量、不同密度的N2和CO B 同温度、同体积的H2和N2
C 同体积、同密度的C2H4和C3H6 D 同压强、同体积的N2O和CO2
2007全国1卷
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的是
A.p (Ne)>p (H2)>p (O2) B.p (O2)>p (Ne)>p (H2)
C.p (H2)>p (O2)>p (Ne) D.p (H2)>p (Ne)>p (O2)
2007北京卷
对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A.若质量相等,则质子数相等 B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等 D.若体积相等,则密度相等
2007重庆卷
下列叙述正确的是
A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等
B.等物质的量的甲基(-CH3)与羟基(-OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16 g CH4与18 g NH4+所含质子数相等
2007四川卷
NA代表阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4LCHCl3中含有氯原子数目为3NA
B.7gCnH2n中含有的氢原子数目为NA
C.18 g D2O中含有的质子数目为10NA
D.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA
2007海南卷
下列叙述正确的是
A. 一定温度、压强下,气体体积由其分子的大小决定
B. 一定温度、压强下,气体体积由其物质的量的多少决定
C. 气体摩尔体积是指1mol任何气体所占的体积为22.4L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
2007宁夏卷
若NA表示阿佛加德罗常数,下列说法正确的是
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol 甲烷的质量比为7 :4
2007宁夏卷 a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4 的物质的量之比为
A.1 :7 B.7 :1 C.7 :8 D.8 :7
2008四川卷
下列说法不正确的是
A.1mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4L
B.1mol臭氧和1.5mol氧气含有相同的氧原子数
C.等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3∶1
D.等物质的量的干冰和葡萄糖中所含碳原子数之比为1∶6,氧原子数之比为1∶3
2008四川卷
在aLAl2(SO4)3和(NH4)2SO4的混合物溶液中加入b molBaCl2,恰好使溶液中的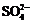 离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为
离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为
A.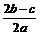 B.
B.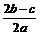 C.
C.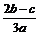 D.
D.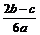
2008四川延考卷
下列叙述中正确的是
A.22.4L氧气中必然含有6.02×1023个氧分子
B.同温同压下,原子数均为6.02×1023个的氢气和氦气具有相同的体积
C.0.50mol的硫酸钠中含有6.02×1023个钠离子
D.1.0L浓度为1.0mol·L-1的一元酸溶液中含有 6.02×1023个氢离子
2008山东卷
NA代表阿伏加德罗常数,下列叙述错误的是
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2S04的质量分数为9.8%
B.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,l L 0.50 mol·L-1NH4Cl溶液与2 L0.25 mol·L°NN4Cl溶液含NH4+物质的量不同
2008海南卷
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:
A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小
2008海南卷
设NA为阿伏加德罗常数,下列说法正确的是:
A.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
B.标准状况下,14g氮气含有的核外电子数为5NA
C.标准状况下,22.4L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
2008广东卷
设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是
A.1 mol Cl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为0.1nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
2009全国1卷
将l5 mL 2 mol·L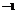 Na2CO3溶液逐滴加入到40 mL 0.5 mol·L
Na2CO3溶液逐滴加入到40 mL 0.5 mol·L MCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是
MCln盐溶液中,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,则MCln中n值是
A.4 B.3 C.2 D.1
2009宁夏卷
将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为

A.NO2
B.N2O2
C.N2O D.N2O4

2009海南卷
下列叙述正确的是(用NA代表阿伏加德罗常数的值)
A.2.4g金属镁变为镁离子时失去的电子数为0.1NA
B.1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等
C.在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA
D.CO和N2为等电子体,22.4L的CO气体与lmol
N2所含的电子数相等
2009福建卷
设NA为阿伏伽德罗常数,下列叙述正确的是
 A. 24g镁的原子最外层电子数为NA B. 1L0.1mol·L-1乙酸溶液中H+数为0.1NA
A. 24g镁的原子最外层电子数为NA B. 1L0.1mol·L-1乙酸溶液中H+数为0.1NA
 C. 1mol甲烷分子所含质子数为10NA D. 标准状况下,22.4L乙醇的分子数为NA
C. 1mol甲烷分子所含质子数为10NA D. 标准状况下,22.4L乙醇的分子数为NA
2009浙江卷
用NA表示阿伏加德罗常数的值,下列说法正确的是

A.标准状况下,5.6L一氧化氮和5.6L氧气混合后的分子总数为0.5NA

B.1mol乙烷分子含有8NA个共价键

C.58.5g的氯化钠固体中含有NA个氯化钠分子 

D.在1L0.1mol·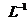 碳酸钠溶液中,阴离子总数大于0.1 NA
碳酸钠溶液中,阴离子总数大于0.1 NA

2009江苏卷
用Na表示阿伏加德罗常数的值。下列叙述正确的是
A. 25℃时,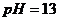 的
的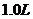
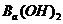 溶液中含有的
溶液中含有的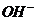 数目为0.2Na
数目为0.2Na
B. 标准状况下,2.24LCl2与过量稀NaOH溶液反应,转移的电子总数为0.2Na
C. 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5Na
D. 标准状况下,22.4L 甲醇中含有的氧原子数为1.0Na
2009上海卷
NA代表阿伏加德罗常数。下列有关叙述正确的是
A.标准状况下,22.4LH2O含有的分子数等于0.1NA
B.常温下.100mL 1mol/LNa2CO3溶液中阴离子总数大于0.1NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.3.4gNH3中含N-H键数目为0.2NA
V溶液(L )
)
3、c与质量分数的换算关系

 4、稀释规律
V气体(标准状态)(L)
4、稀释规律
V气体(标准状态)(L)
4、Vm与22.4L/mol的关系:
 这就是赫赫有名的
这就是赫赫有名的
 1、物质的量浓度的概念:
1、物质的量浓度的概念:
|
2、气体摩尔体积的概念: ④在同温同压下,相同 的任何气体都具有相同的分子数(或物质的量)(“三同定一同”)
 3、表达式:
3、表达式:
3、表达式:


 (1)粒子本身大小
①1mol气体体积由
决定
(1)粒子本身大小
①1mol气体体积由
决定
决定 物质的体积
 1、决定物质体积 (2)粒子的多少
②一定温度、压强下的气体体积由
决定
1、决定物质体积 (2)粒子的多少
②一定温度、压强下的气体体积由
决定
大小的因素 决定 物质的体积
(3)粒子之间距离 ③一定温度、压强下,1mol任何气体体积是 的

 1、摩尔质量的概念:
1、摩尔质量的概念:
2、 M与相对分子质量或相对原子质量的关系
2、注意事项 ⑶1mol氢 ( )
⑶1mol氧 ( ) II、使用时注明粒子的名称
4.恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 2NH3(g)
2NH3(g)
若反应进行到某时刻t时,nt(N2)=13mol ; nt(NH3)=6 mol,计算a的值。
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3)原混合物气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)= 。
(4)原混合气体中,a:b= 。
(5)达到平衡时,N2和H2的转化率之比,α(N2):α(H2)= 。
(6)平衡混合气体中,n(N2):n(H2):n(NH3)= 。
3.在830 K时,可逆反应CO+H2O?H2+CO2,及其平衡具有某些特殊性。若起始浓度[CO]为2 mol/L,[H2O]为3 mol/L,反应达到平衡时,CO转化为CO2的转化率为60%;如果将H2O的起始浓度加大到6 mol/L,则CO的转化率为75%。
请观察上述有关数据,找出规律,填写以下空白。
设830K时,起始浓度[CO]为a mol/L,[H2O]为b mol/L,反应达到平衡时[H2]为c mol/L。(1)当b不变,a减小,重新达到平衡时,CO的转化率 ,H2O的转化率 。(填“增大”、“减少”或“不变”)
(2)a=5,c= 20/9 时,b= 。 (3)当a=b时,c/a = 。
(4)a、b、c在该平衡中的关系式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com