
讲析:10.用平衡常数比较弱酸的相对强弱时应在相同温度下比较,浓度对比较没有影响。反应速率与温度、浓度、压强等因素有关,而与反应热无关。
12.A选项的离子方程式电荷不守恒;D选项中由于NaHCO3过量,NaHCO3与Ba(OH)2的物质的量之比为2:1,离子方程式应为:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O.
讲析:1.我国1965年首次合成具有生物活性的结晶牛胰岛素。2.从题干中可知运用的是“质谱分析法”和“核磁共振技术”。4.肥皂水具有碱性,可使甲氟磷酸异丙酯水解。5.CaH2中有H-。6.X化学式的求法:C8H14N2O5+H2O-C3H7NO2=C5H9NO4
8.稀释前:[H+]=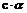 =10-2mol•L-1,稀释后:[H+]=
=10-2mol•L-1,稀释后:[H+]=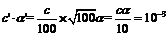 mol•L-1.
mol•L-1.
6.某化学研究性学习小组在研究结晶水合物(MSO4•2H2O)的过程中,做了如下实验;将结晶水合物放在坩埚中加热,加热前和加热后都进行称量。随着实验次数的增加,加热的时间不断延长,他们在实验中将数据整理如下表
|
实验顺序 (按序延长加热时间) |
固体质量/g |
|
|
加热前 |
加热后 |
|
|
1 |
5.16 |
4.89 |
|
2 |
5.16 |
4.68 |
|
3 |
5.16 |
4.35 |
|
4 |
5.16 |
4.35 |
|
5 |
5.16 |
4.20 |
|
6 |
5.16 |
4.17 |
|
7 |
5.16 |
4.08 |
|
8 |
5.16 |
4.08 |
(注:在上述实验温度下,MSO4不分解)
利用数据可绘制成如右图所示的图像:
 (1)利用实验数据,通过计算确定M元素的相对原子质量,并写出其元素符号。
(1)利用实验数据,通过计算确定M元素的相对原子质量,并写出其元素符号。
(2)通过计算解释图像中产生ab段的原因以及ab段时坩埚中固体物质的化学式。
25.(7分)某石灰厂利用本地资源石灰石(所含杂质高温不分解,也不跟酸反应)。在石灰窑内高温煅烧生产石灰,取煅烧后的样品5.92g跟25.0mL盐酸恰好完全反应,放出44.8mLCO2(标准状况),滤出残渣0.120g。请计算(1)石灰石中碳酸钙转化率。(2)盐酸中溶质的物质的量浓度。
24.(12分)绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的原子经济性反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物的总质量之比。
一种类似有机玻璃的塑料--聚丁烯酸甲酯有广泛的用途。合成这种有机塑料有不同的途径。以下合成途径副产品多为低污染或无污染物,原子利用率较高,因此较为符合“绿色化学”的要求。
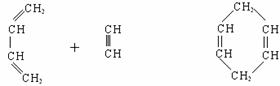
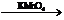

其反应过程是:
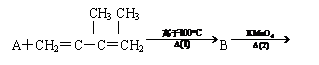
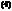 C
C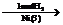 D
D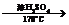 E
E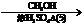
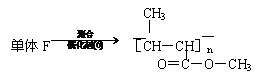
(1)写出图中化合物A、B、E的结构简式:
A ;B ;E 。
(2)在有机反应中,加成类型的原子利用率最高。本反应过程中,属于此类反应特点的有 。
(3)写出与Na2CO3溶液不反应的D的同分异构体(只要写出两种) 、. 。
(4)写出下列反应的化学方程式:

①
②E→F:
23.(11分)据报道,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS-Na(对氨基水杨酸钠)也是其中一种,它与雷米封同时服用,可以产生协作用。

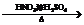
 (苯胺、弱碱性、易氧化)
(苯胺、弱碱性、易氧化)
③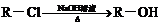
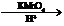

下面是PAS-Na的一种合成路线
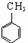
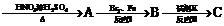
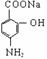
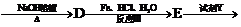
(对氨基水杨酸钠)
请按要求回答下列问题
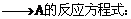 (1)
(1)
A B的反应方程式:
B的反应方程式:
(2)写出下列物质的结构简式:
C ;D 。
(3)指出反应类型:I ;II ;III 。
(4)所加试剂名称:X ;Y 。
22.(9分)下图①到⑩分别代表反应中的一种物质,且它们均为化学中的常见物质
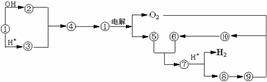
(1)①化学式为 ,⑤和⑥反应的化学方程式为 。
(2)实验室由⑧制取⑨的离子方程式为 ,⑨转变⑩的化学方程式为 。由⑨转变为⑩的反应现象为 。
21.用“>、=、<”填写下列空白:
(1)取0.2mol/LHX溶液与0.2mol/LNaOH溶液等体积混合,测得混合溶液中c(Na+)>c(X-)。
①混合溶液中c(HX) c(X-)
②混合溶液中c(HX)+c(X-) 0.1mol/L(忽略体积变化)
③混合溶液中由水电离出的c(OH-) 0.2mol/LHX溶液中由水电离出的c(H+)。
(2)如果取0.2mol/LHX溶液与0.1mol/LNaOH溶液等体积混合,则得混合溶液的pH>7,则说明HX的电离程度 NaX的水解程度。
20.(10分)某同学通过下列装置进行实验,推断SO2与Na2O2反应的产物,已知SO2可由浓H2SO4与Na2SO3反应制取,Na2O2完全反应。

(1)怎样确定反应中是否有O2生成?
(2)装置B的作用是
装置D的作用是
(3)该同学为了确定另一产物是Na2SO3还是Na2SO4,设计实验如下:

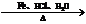
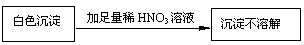

你认为该同学的实验是否合理 ,理由是
。
若你认为不合理,请你设计一个合理实验来确定产物(括号内填加入物质,方框内填现象);若你认为合理,可不回答此问。


19.(10分)草酸晶体组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
(1)称取Wg草酸晶体,配成100.00mL水溶液。
(2)取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀硫酸后,用浓度为amol/L的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答:
①下列仪器在实验中不需要的有 。
a.托盘天平 b.滴定管 c.100mL量筒 d.100mL容量瓶 e.烧杯 f.漏斗 g.锥形瓶
h.玻璃棒 i.药匙 j.烧瓶
②实验中,标准液KMnO4溶液应装在酸式滴定管中,因为 。
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值 (偏大、偏小、无影响)。
④在滴定过程中若用去amol/L的KMnO4的溶液VmL,则所配制的草酸溶液的物质的量浓度为 mol/L,由此计算x的值是 。
⑤若滴定终点时计数目光俯视,由此计算的x值可能会 (偏大、偏小、无影响)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com