
5.16g 4.08
(M+132):(M+96)=5.16g:4.08
M=40 为Ca元素
(2)CaSO4•2H2O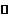 CaSO4•(2-x)H2O+xH2O
CaSO4•(2-x)H2O+xH2O
172 18x
26.(1)MSO4•2H2O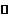 MSO4+2H2O
MSO4+2H2O
M+132 M+96
26.(1)40,Ca (2)2CaSO4•H2O(或CaSO4•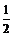 H2O)
H2O)
因为在加热过程中生石膏CaSO4•2H2O转化为相对稳定的2 CaSO4•H2O,所以出现了图像中的ab段。
讲析:25.(1)CaCO3+2HCl=CaCl2+H2O+CO2↑
100g 22.4L
m(CaCO3) 0.0448L
m(CaCO3)=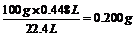
则残留物中CaO为:5.92g-0.200g-0.120=5.60g
由此分解的CaCO3为:10.0g。
CaCO3的分解率: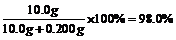
(2)n(HCl)=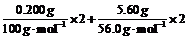
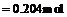
c(HCl)=0.204mol/0.025L=8.16mol/L
24.必须根据题中信息和反应物到目标产物一系列转化中的条件判断各物质的结构,再回答题中各问题。
24.(1)CH≡CH; ;CH3CH=CH-COOH.
|
(2)1,3,6 (3) 、
CH3-COOCH2CH2-OH
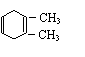
(4)①CH≡CH+CH2=C-C=CH2

| |
CH3CH3
②CH3CH=CH-COOH+CH3OH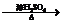
CH3CH=CHCOOCH3+H2O
|
 讲析:23.根据最终生成物的结构和合成路线中各步反应的条件推导各有机物结构,需要注意到的是:有关基因在苯环上的位置应根据生成物的结构判断;为防止-NH2被氧化,应先将-CH3氧化成-COOH;要使(E)
讲析:23.根据最终生成物的结构和合成路线中各步反应的条件推导各有机物结构,需要注意到的是:有关基因在苯环上的位置应根据生成物的结构判断;为防止-NH2被氧化,应先将-CH3氧化成-COOH;要使(E)
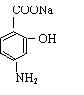 |
|||
|
|||
|
虑,加入NaHCO3溶液。
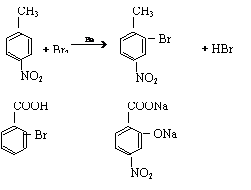
23.(1)
|
(3)取代;氧化;还原
(4)酸化的KMnO4溶液;NaHCO3溶液。
22.物质①既能与酸又能与碱反应,且电解后产生O2,可推知该物质为Al2O3,电解反应得到单质Al,⑤⑥反应后又能得到与H+反应产生H2的物质,则该反应为Al与Fe2O3的铝热反应。
22.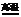 (1)Al2O3;2Al+Fe2O3 2Fe+Al2O3
(1)Al2O3;2Al+Fe2O3 2Fe+Al2O3
(2)Fe2++2OH-=Fe(OH)2↓;
4Fe(OH)2+O2+2H2O=4Fe(OH)3↓白色沉淀迅速变成灰绿色,最终变成红褐色。
讲析:21.(1)因HX与NaOH恰好完全反应生成NaX,溶液中c(Na+)>c(X-)说明NaX能水解,HX应为弱酸,在NaX溶液中X-水解产生一定量的HX,但水解程度小,c(HX)<c(X-);由守恒关系应有c(HX)+c(X-)=0.1mol•L-1;NaX的溶液中X-水解促进水的电离,而HX电离出的H+抑制水的电离。(2)0.2mol•L-1HX与 0.1 mol•L-1NaOH等体积混合反应后得等物质的量HX和NaX,因pH>7,则HX的电离程度小于NaX的水解程度。
20.(1)用带火星的木条靠近干燥管嘴,观察是否燃烧。(2)干燥SO2,防止水蒸气进入C装置与Na2O2反应;防止空气中的水蒸气进入C装置与Na2O2反应,同时吸收过量的SO2防止污染空气。(3)不合理;固体中有Na2SO3时,因SO32-能被稀硝酸氧化也具有此现象。(4)盐酸;无明显现象;BaCl2溶液[或Ba(NO3)2溶液];白色沉淀。
讲析:19.(3)水的加入不影响溶质的量。(4)消耗的KMnO4的物质的量:aV×10-3mol,n(H2C2O4)=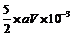 mol
mol
c(H2C2O4)=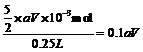 mol·L-1;求x值 :
mol·L-1;求x值 :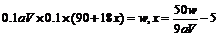 ,(5)由
,(5)由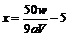 分析,当终点俯视读数时,使V偏小,从而x偏大。
分析,当终点俯视读数时,使V偏小,从而x偏大。
13.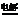 该装置中实质为电解CuSO4溶液,2CuSO4+2H2O
该装置中实质为电解CuSO4溶液,2CuSO4+2H2O
2Cu+2H2SO4+O2↑当电极上转移的电子为4mol时,则反应的CuSO4、H2O生成的Cu、H2SO4均为2mol,生成的O2为1mol。14.由图分析,平衡达C后增加压强,平衡向逆反应方向移动,则正反应方向为气体体积增大的方向;温度越高,AB%越小,正反应为放热反应。15.A、B、C、D、E分别为C、N、O、H、Mg元素。16.由有关方程式分析应有关系:N2~3H2~CO2,即H2与CO2物质的量之比为3:1时最能充分利用原料。因C5H12+10H2O 5CO2+16H2,C6H14+12H2O
5CO2+16H2,C6H14+12H2O 6CO2+19H2,生成的CO2与H2物质的量之比最接近1:3。17.因金属与硝酸反应有硝酸盐生成,加稀硫酸后,溶液中又有稀硝酸,无论剩余金属的组成如何都能继续反应。18.将第二组数据扩大1倍得:8gA和28gB混合气体体积为896mL,与第一组数据比较可得11gB气体的体积为224mL,则14gB气体体积为:14g/11g×224mL=285mL,4gA气体的体积为:448mL-285mL=163mL,由此:M(A):M(B)=
6CO2+19H2,生成的CO2与H2物质的量之比最接近1:3。17.因金属与硝酸反应有硝酸盐生成,加稀硫酸后,溶液中又有稀硝酸,无论剩余金属的组成如何都能继续反应。18.将第二组数据扩大1倍得:8gA和28gB混合气体体积为896mL,与第一组数据比较可得11gB气体的体积为224mL,则14gB气体体积为:14g/11g×224mL=285mL,4gA气体的体积为:448mL-285mL=163mL,由此:M(A):M(B)=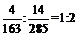 .
.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com