
3.下列变化中,需加入还原剂的是 ( )
A、SO32-→SO2 B、S2-→S C、CO2→H2CO3 D、CO2→CO
2.有关氧化还原反应的叙述正确的是 ( )
A、氧化还原反应的实质是有氧元素的得失
B、氧化还原反应的实质是元素化合价的升降
C、氧化还原反应的实质是电子的转移(得失或偏移)
D、物质所含元素化合价升高的反应是还原反应
1.下列反应一定属于氧化还原反应的是 ( )
A、化合反应 B、分解反应 C、置换反应 D、复分解反应
2、根据反应中物质是否得到氧或失去氧,分为氧化反应和还原反应。
⑴氧化反应:物质
氧的反应,比如:C+O2 CO2
CO2
⑵还原反应:物质
氧的反应,比如:CuO+H2 Cu+H2O
Cu+H2O
课堂研究
[讨论1]对于反应Fe2O3+3CO 2Fe+3CO2, 失去氧,发生了 (填“氧化”或“还原”)反应; 得到氧,发生了 (填“氧化”或“还原”)反应。也就是说,氧化反应和还原反应是
(填“先后”或“同时”)发生的。
2Fe+3CO2, 失去氧,发生了 (填“氧化”或“还原”)反应; 得到氧,发生了 (填“氧化”或“还原”)反应。也就是说,氧化反应和还原反应是
(填“先后”或“同时”)发生的。
氧化还原反应的第一层定义:凡是物质有 氧和 氧的反应。
[讨论2]对于反应Fe2O3+3CO 2Fe+3CO2,讨论该氧化还原反应中元素的化合价在反应前后的变化关系:
元素的化合价升高,
元素的化合价降低。
2Fe+3CO2,讨论该氧化还原反应中元素的化合价在反应前后的变化关系:
元素的化合价升高,
元素的化合价降低。
[思考]①是否只有得氧失氧的反应才是氧化还原反应?
②如果一个反应中没有氧的得失,是否一定不是氧化还原反应呢?
|
反应 |
是否氧化还原反应 |
“得”“失”氧 |
化合价升降 |
氧化还原情况 |
|
C+2CuO=2Cu+CO2 |
|
C 氧 CuO 氧 |
碳元素 铜元素 |
C发生 反应 CuO发生 反应 |
|
2Na+Cl2=2NaCl |
|
|
钠元素 氯元素 |
钠发生 反应 氯气发生 反应 |
氧化还原反应的第二层定义:氧化还原反应是物质有化合价 和 的反应。
氧化反应:物质所含元素化合价 的反应;还原反应:物质所含元素化合价
的反应。判断一个反应是否为氧化还原反应的依据: 。
例题1:下列反应属于氧化还原反应的是 ( )
A、CaCO3+2HCl=CaCl2+H2O+CO2↑ B、CaCO3高温CaO+CO2↑
C、Na2O+H2O=2NaOH D、Mg+2HCl=MgCl2+H2↑
例题2:在反应MnO2+4HCl=MnCl2+2H2O+Cl2↑中, 元素化合价升高,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应; 元素化合价降低,被 (填“氧化”或“还原”),发生 (填“氧化”或“还原”)反应。
[讨论3]化学反应的本质是原子间的重新组合。那么氧化还原反应的本质又是什么呢?在反应中为什么会有元素化合价的升降呢?
⑴钠与氯气的反应:2Na+Cl2=2NaCl
Na:化合价 , (得或失)电子,被 ,发生 反应;
Cl:化合价 , (得或失)电子,被 ,发生 反应。
在这个反应中, 是还原剂, 是氧化剂。
⑵氢气与氯气的反应:H2+Cl2=2HCl
H:化合价 ,电子对 ,被 ,发生 反应;
Cl:化合价 ,电子对 ,被 ,发生 反应。
在这个反应中, 是还原剂, 是氧化剂。
氧化还原反应的第三层定义:氧化还原反应是有电子 (得失或 )的反应。
氧化反应表现为被氧化的元素化合价 ,其实质是该元素的原子 (或偏离)电子的过程;还原反应表现为被还原的元素化合价 ,其实质是该元素的原子 (或偏向)电子的过程。氧化还原反应的本质是 。
例题3:下列叙述正确的是 ( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的得失或偏移
[思考]请分析四种基本反应类型的反应与氧化还原反应之间的关系,并试着画出它们之间的交叉分类示意图,然后列举一些具体的化学反应加以说明。
[总结]
|
|
得氧失氧观点 |
化合价升降观点 |
电子转移观点 |
|
氧化反应 |
|
|
|
|
还原反应 |
|
|
|
|
氧化还原反应 |
|
|
|
课后巩固
1、根据反应物和生成物的类别及反应前后物质种类的多少,化学反应分为四种基本类型,并分析下列十个反应各属于哪种类型。
⑴化合反应:A+B=AB ( )
⑵分解反应:AB=A+B ( )
⑶置换反应:A+BC=AC+B ( )
⑷复分解反应:AB+CD=AD+BC ( )
化学反应:
①2KClO3 2KCl
+ 3O2↑ ②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
2KCl
+ 3O2↑ ②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
③Zn+H2SO4=ZnSO4+H2↑ ④2H2+O2 2H2O
2H2O
⑤CaCO3 CaO+CO2↑ ⑥Ba(OH)2+H2SO4=BaSO4↓+2H2O
CaO+CO2↑ ⑥Ba(OH)2+H2SO4=BaSO4↓+2H2O
⑦2Na+Cl2 2NaCl ⑧3Fe2O3+8Al
2NaCl ⑧3Fe2O3+8Al 9Fe+4Al2O3
9Fe+4Al2O3
⑨Na2CO3+2HCl=2NaCl+CO2↑+H2O ⑩NH3+HCl=NH4Cl
|
|
外因的变化 |
备注 |
对反应速率的影响 |
对化学平衡 的影响 |
|
浓度 |
增大反应物的浓度 |
固体物质除外 |
v正、v逆均增大,且v正>v逆 |
向正反应方向移动 |
|
减小生成物的浓度 |
v正、v逆均减小,且v正>v逆 |
|||
|
减小反应物的浓度 |
v正、v逆均减小,且v正<v逆 |
向逆反应方向移动 |
||
|
增大生成物的浓度 |
v正、v逆均增大,且v正<v逆 |
向逆反应方向移动 |
||
|
压强 |
增压引起浓度改变 |
固体和液体、恒容时充入不反应气体情况除外 |
v正、v逆均增大,只是增大的倍数不同 |
向气体体积减小的方向移动 |
|
减压引起浓度改变 |
v正、v逆均减小,只是减小的倍数不同 |
向气体体积增大的方向移动 |
试题枚举
[例1]
下列哪种说法可以证明反应N2 + 3H2  2NH3已达到平衡状态( )
2NH3已达到平衡状态( )
A. 1个N≡ N 键断裂的同时,有3个H - N键形成。
B. 1个N≡ N断裂的同时,有3个H - N键断裂。
C. 1个N≡ N断裂的同时,有6个H - N键断裂。
D. 1个N≡ N键断裂的同时,有6个H - N键形成。
解析:根据化学平衡的定义,当一个可逆反应达到平衡时V正= V逆 ,同时各物质的百分含量保持不变,从本质上来讲反应虽然仍在进行,但各种物质的绝对量不再变化,我们就称为达到平衡状态,对此题关键要分清谁表示V正 谁表示V逆 ,例如,1个N≡N断裂,即表示要向右进行,生成NH3即为V正 ;而6个N-H键断裂表示向左进行,生成N2与H2,即V逆。6个N-H形成,相当于生成2molNH3,表示V正 。根据同一反应中,用不同的物质来表示某反应的速率,若正、逆反应速率之比等于方程式各物质的系数之比,反应亦达到平衡,所以答案为A、C。
答案:A、C
[例2] 能够充分说明在恒温恒容下的密闭容器中,反应2SO2+O2  2SO3已达平衡状态的标志是
2SO3已达平衡状态的标志是
A.容器中SO2、O2、SO3的物质的量之比为2:1:2
B.SO2 和SO3的物质的量浓度相等
C.反应容器内压强不随时间变化而变化
D.单位时间内生成2molSO3 时,即生成1molO2
解析:由于题目中没有给出各物质的起始量,也没有给出反应的具体条件,所以无法知道容器中SO2、O2、SO3的物质的量之比为2:1:2时,及SO2 和SO3的物质的量浓度相等时反应是否达到平衡,也就是说无法知道达到平衡后,SO2 和SO3 的物质的量浓度上否相等。所以A、B选项不能选为答案。由于此反应是气体非等体积反应,在恒温恒容下,压强不变,说明各物质的浓度不变,故C选项正确。由于单位时间内生成2molSO3 时,即消耗了1molO2 ,此时又生成1molO2 ,即意味着正反应速率等于逆反应速率,所以D选项也正确。
答案:C、D
[例3]可逆反应: 3A(g) 3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小趋势,
则下列判断正确的是
3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小趋势,
则下列判断正确的是
A.B和C可能都是固体
B.B和C一定都是气体
C.若C为固体,则B一定是气体
D.B和C可能都是气体
解析: 本题考查平衡移动知识,重在考查分析问题、解决问题的能力.根据题干条件可对各选项逐一分析。选项A中,如果B和C都是固体,则无论平衡怎样移动,反应混合物中的气体只有A一种,A的相对分子质量不随温度升高而改变,所以气体的平均相对分子质量不随温度升高而改变,因此选项A不符合题意.选项C中,当C为固体,B为气体时,该反应为反应前后气体分子数不变的反应.由于温度升高平衡向吸热反应方向移动。有更多的固体C生成,使反应混合物中气体的总质量相应减小,而气体分子数保持不变,所以气体平均相对分子质量也相应变小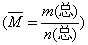 ,若C为固体,而B为非气体时,则反应混合物中的气体只有A,这与选项A情况相同,不符合题意要求,所以只有当C为固体时,B必为气体,才符合回意要求,选项C符合题意.既然选项C符合题意要求,则选项B一定不符合或意要求。选项D中,如果B和C都是气体,则正反应方向是气体分子数增大的方向,由于升温平衡向正反应方向移动,反应混合物中气体分子数相应增大,而反应混合物的总质量保持不变(反应物和生成物全部为气体)。所以气体平均相对分子质量变小.选项D符合题意.
,若C为固体,而B为非气体时,则反应混合物中的气体只有A,这与选项A情况相同,不符合题意要求,所以只有当C为固体时,B必为气体,才符合回意要求,选项C符合题意.既然选项C符合题意要求,则选项B一定不符合或意要求。选项D中,如果B和C都是气体,则正反应方向是气体分子数增大的方向,由于升温平衡向正反应方向移动,反应混合物中气体分子数相应增大,而反应混合物的总质量保持不变(反应物和生成物全部为气体)。所以气体平均相对分子质量变小.选项D符合题意.
答案:C、D。
[例4]密闭容器中一定量的混合气体发生反应: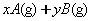

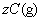 ,平衡时,测得A的浓度为0.50mol·L-1,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30mol·L-1,有关叙述不正确的是(
)。
,平衡时,测得A的浓度为0.50mol·L-1,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30mol·L-1,有关叙述不正确的是(
)。
A.平衡一定向右移动
B.B的转化率降低
C.
D.C的体积分数降低
解析:本题可采用虚拟的方法来解答。假设把容器扩大到原来的2倍时.平衡不移动(虚拟),则这时A的浓度由 0.50 mol·L-l变为0. 25 mol·L-l,而事实上A的浓度为 0.30 mol·L-1,然后再由虚拟状态回到事实.A的浓度由0.25 mol·L-1变为0.30 mol·L-1,平衡向生成A的方向即本反应逆反应方向移动。与备选选项对照,只有A项不正确。
答案:A
如果改变影响平衡的一个条件(如浓度、压强或温度),平衡就向着能够减弱这种改变的方向移动。
4.“变”--任何化学平衡状态均是暂时的、相对的、有条件的(与浓度、压强、温度等有关)。而与达平衡的过程无关(化学平衡状态既可从正反应方向开始达平衡,也可以从逆反应方向开始达平衡)。
3.“动”--指定化学反应已达化学平衡状态时,反应并没有停止,实际上正反应与逆反应始终在进行,且正反应速率等于逆反应速率,所以化学平衡状态是动态平衡状态。
2.“定”--当一定条件下可逆反应一旦达平衡(可逆反应进行到最大的程度)状态时,在平衡体系的混合物中,各组成成分的含量(即反应物与生成物的物质的量,物质的量浓度,质量分数,体积分数等)保持一定而不变(即不随时间的改变而改变)。这是判断体系是否处于化学平衡状态的重要依据。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com