
1.电离方程式的书写:
⑴强电解质用“=”,弱电解质用“ ”
”
⑵多元弱酸分步电离,以第一步为主:
例如:NaCl=Na++Cl-
NH3·H2O NH4++OH-
NH4++OH-
H3PO4  H++H2PO4-(为主)
H++H2PO4-(为主)
(3)酸式盐:强酸的酸式盐完全电离,一步写出,如NaHSO4=Na++H++SO42一。弱酸的酸式盐强中有弱
分步写出:如NaHCO3=Na++ HCO3一;HCO3一=CO32一+ H+
7.电离方程式的书写及弱电解质溶液中粒子浓度关系
6.弱电解质的电离平衡
(1)特征: ①动:υ(电离)=υ(结合)≠0的动态平衡②定:条件一定,分子和离子浓度一定③ 变:条件改变,平衡破坏,发生移动
(2)影响因素(以CH3COOH  CH3COO-+ H+为例)
CH3COO-+ H+为例)
①浓度:加水稀释促进电离,溶液中n(H+)增大,c(H+)减小②温度:升温促进电离(因为电离过程是吸热的)③相关离子:例如加入无水CH3COONa能抑制电离,加入盐酸也抑制电离,加入碱能促进电离,仍然符合勒夏特列原理
5.弱电解质的电离平衡
(1)特征: ①动:υ(电离)=υ(结合)≠0的动态平衡②定:条件一定,分子和离子浓度一定③ 变:条件改变,平衡破坏,发生移动
(2)影响因素(以CH3COOH  CH3COO-+ H+为例)
CH3COO-+ H+为例)
①浓度:加水稀释促进电离,溶液中n(H+)增大,c(H+)减小②温度:升温促进电离(因为电离过程是吸热的)③相关离子:例如加入无水CH3COONa能抑制电离,加入盐酸也抑制电离,加入碱能促进电离,仍然符合勒夏特列原理
4.弱电解质的电离平衡
⑴ 概念:在一定条件下(如温度,浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率 时,电离过程就达到了 状态,这叫做电离平衡。
⑵ 弱电解质电离平衡的特点:
①“动”: 。②“等”: 。
③“定”: 。④“变”: 。
⑶弱电解质电离平衡的影响因素:
内因(主要因素):
外因(次要因素):
①浓度: 。②温度: 。
③酸碱性: 。④其它条件: 。
⑷电离平衡常数:
一元弱酸:CH3COOH CH3COO-+H+
CH3COO-+H+
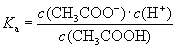
①电离平衡常数化是 函数, 不变K不变。
②K值越 ,该弱电解质较易电离,其对应的弱酸弱碱较强;K值越 ,该弱电解质越难电离,其对应的弱酸弱碱越弱;即 K值大小可判断弱电解质相对强弱。
3.强、弱电解质比较
|
比较的项目 |
强电解质 |
弱电解质 |
|
定义 |
|
|
|
化合物类型 |
|
|
|
物质类别 |
|
|
|
离子浓度 |
|
|
|
导电能力 |
|
|
|
电离程度 |
|
|
|
电离平衡 |
|
|
|
溶液中溶质微粒 |
|
|
|
电离方程式 |
|
|
2.强电解质和弱电解质
⑴强电解质的概念: 常见物质类别: 。
⑵弱电解质的概念: 常见物质类别: 。
1.电解质和非电解质
⑴电解质的概念: 常见物质类别: 。
⑵非电解质的概念: 常见物质类别: 。
4. 了解酸碱电离理论。
知识梳理
[讨论与思考]请指出下列物质中哪些是电解质,哪些是非电解质,哪些既不是电解质也不是非电解质,哪些是强电解质,哪些是弱电解质(填序号),并说出你的判断依据。
⑴H2SO4 ⑵液氨 ⑶Ca(OH)2 ⑷石墨 ⑸NH3·H2O ⑹H2O ⑺CH3COONH4 ⑻C2H5OH ⑼CaCO3 ⑽氨水 ⑾H3PO4 ⑿Na2O
电解质: 判断依据:
非电解质: 判断依据:
既不是电解质也不是非电解质:
判断依据:
强电解质: 判断依据:
弱电解质: 判断依据:
3. 会书写常见弱电解质的电离方程式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com