
19.(7分)实验室中要制得较纯净的Fe(OH)2沉淀(不必从水溶液中滤出),现有下列实验用品:15×150试管、胶头滴管、100mL烧杯、玻璃棒、铁架台(带铁圈)、石棉网、酒精灯、药匙、普通漏斗及滤纸、细铁粉、氢氧化钠(分析纯)、久置绿矾、久置蒸馏水、苯、四氯化碳、无水乙醇、稀硫酸。
请选用合理的仪器和试剂并采用必要的操作方法完成实验步骤(不准将胶头滴管伸入反应器中):
(1)配制溶液(无严格的浓度及量的限制,有关仪器组装可省略)。
①配制NaOH溶液:选取适量NaOH固体于洁净的烧杯中,加入适量煮沸过的蒸馏水,搅拌制得NaOH溶液备用。
②配制纯FeSO4溶液:
;
③制较纯净的Fe(OH)2沉淀
;
(2)配制NaOH溶液及FeSO4溶液所用的蒸馏水,应先加热煮沸并冷却后再使用,其目的是 。
18.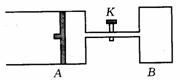 如图所示,向A中充入1molX和1molY,向B中充入 2molX和2molY,起始VA=VB=aL, 在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)
+ Y(g)
如图所示,向A中充入1molX和1molY,向B中充入 2molX和2molY,起始VA=VB=aL, 在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)
+ Y(g)  2Z(g)+W(g);ΔH>0 达到平衡时,VA=1.2aL。则下列说法错误的是 ( )
2Z(g)+W(g);ΔH>0 达到平衡时,VA=1.2aL。则下列说法错误的是 ( )
A.反应开始时,B容器中化学反应速率快
B.A容器中X的转化率为40%,且比B容器中X的转化率小
C.打开K一段时间达新平衡时,A的体积为1.6 aL(连通管中气体体积不计)
D.打开K达新平衡后,升高B容器温度,A容器体积会增大
第Ⅱ卷 (非选择题 共78分)
17.在标准状况下,将amolH2S和bmolO2混合充分燃烧后,两反应物都没有剩余,得到三种产物(S、SO2和H2O),则下列判断不正确的是 ( )
A.产生的SO2是(b-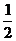 a)mol
a)mol
 B.反应后生成的水质量为18ag
B.反应后生成的水质量为18ag
C.3a>2b>a
D.反应后氧化产物的质量为(16a-32b)g
16.
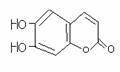 草药秦皮中含有的七叶树内酯
(环上氢原子未标出,每个折点表示一个碳原子),具有抗菌作用。若1mol七叶树内酯分别跟浓溴水和NaOH溶液完全反应,则消耗的溴和NaOH的物质的量分别为
(
)
草药秦皮中含有的七叶树内酯
(环上氢原子未标出,每个折点表示一个碳原子),具有抗菌作用。若1mol七叶树内酯分别跟浓溴水和NaOH溶液完全反应,则消耗的溴和NaOH的物质的量分别为
(
)
A.3mol,2mol B.3mol,4mol
C.2mol,3mol D.4mol,4mol
15.六苯乙烷为白色固体,其结构表示如图:( )
 下列有关说法中不正确的是
下列有关说法中不正确的是
A.它是一种芳香烃,易溶于乙醚中
B.它的分子式为C38H30,是非极性分子
C.它的一氯代物只有一种
D.在同一平面上的原子最多有14个
14.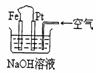 有关右图装置中的叙述正确的是
( )
有关右图装置中的叙述正确的是
( )
A.这是电解NaOH溶液的装置
B.这是一个原电池装置
C.Pt为正极,其电极反应为:O2+2H2O+4e-=4OH-
D.Fe为阳极,其电极反应为:Fe-2e-+2OH-=Fe(OH)2
13.下列反应的离子方程式正确的是 ( )
A.硫酸亚铁在空气中氧化:4Fe2++3O2+6H2O=4 Fe (OH)3
B.向Ba(OH)2溶液中加入少量的NH4HSO4溶液:
Ba2++2OH―+NH4++H++SO42―=BaSO4↓+NH3•H2O+H2O
C.用石墨电极电解CuSO4溶液:
2Cu2++4OH- 2Cu↓+O2↑+2H2O
2Cu↓+O2↑+2H2O
D.用澄清石灰水吸收过量二氧化碳气体:
OH-+CO2=HCO3-
12.某溶液中含有大量Fe2+、Fe3+、Mg2+和NH4+,其C(H+)=10-2mol·L-1,在该溶液中可以大量存在的阴离子是
( )
A.HCO3- B.NO3-
C.SO42- D.SCN-
11.常温下用水稀释0.1 mol·L-1醋酸钠溶液,溶液增大的是 ( )
A.c(H+) B.c(H+)·c(OH-)
C.c(OH-) D.c(H+)/ c(CH3COOH)
10.短周期元素A、B、C原子序数依次递增,A、C在周期表中的位置相邻,B原子最外层电子数等于A原子次外层电子数,这三种元素原子的最外层电子数之和为10。由此推断下列叙述正确的是 ( )
A.原子半径A<B<C
B.A的氢化物的稳定性大于C的氢化物
C.B的氧化物的熔点比A的氧化物熔点高
D.A与C可形成离子化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com