
11.
(1)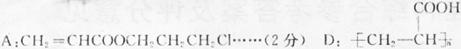
 (2)e、b(或e、e、b)
(2)e、b(或e、e、b)
(3)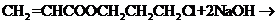
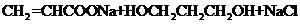
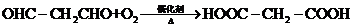

11.(1 5分)有机物A-I有如下转化关系,其中C在一定条件下最终能生成B。

试回答:
(1)写出A、D的结构简式:
A____________________,D________________________。
(2)由C最终转化为B所经历的反应类型为(按反应先后顺序填写序号) ____________
a.取代 b.消去 c.加成 d水解 e.氧化 f.还原
(3)写出下列化学方程式:
A→E+F_________________________________________________________________
G→H___________________________________________________________________
(4)另一种有机物M与F有相同的相对分子质量(组成元素相同),0.1mol M分别与足量Na、NaHCO3反应,放出气体的体积相同(同温同压)。试写出M的结构简式:_______________
________________
10.(9分)猜想①:与BaCl2反应有沉淀生成。
⑴不正确。过量氯水中也含Cl-
⑵取“猜想③”反应后的溶液滴加BaCl2溶液,观察到有白色沉淀产生,则氯水可将Na2S2O3氧化。S2O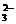 +5H2O+4Cl2===2SO42-+8Cl-+10H+
+5H2O+4Cl2===2SO42-+8Cl-+10H+
10. (9分)硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。
(9分)硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。
某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
提出问题:Na2S2O3是否与Na2SO4具备相似的下列性质呢?
猜想①: ;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
实验探究:基于上述猜想②、③,设计实验方案。
|
|
实验操作 |
实验现象或 预期实验现象 |
现象解释(用离子 方程式表示) |
|
猜想② |
|
溶液pH=8 |
- |
|
向pH=2的硫酸中滴加Na2S2O3溶液 |
|
S2O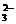 +2H+=== +2H+===S↓+SO2↑+H2O |
|
|
猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
|
实验结果:Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
问题讨论:

 (1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由 。
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由 。
(2)请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是
。
写出Na2S2O3被Cl2氧化的离子反应方程式: 。
9.(本题15分)

 (1)(6分)
(1)(6分)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V正 < V逆(3分) |
|
|
|
|
|
|
|
|
|
|
0.40(3分) |
|
(2)25%(2分);不变(2分);1:a(2分); (3)-78.7 (3分)
9.(本题15分)水煤气 (主要成分:CO、H2 )
是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得: C (s)
+ H2O(g)
C (s)
+ H2O(g) CO
(g) +H2 (g);△H =+131.3kJ•mol-1
CO
(g) +H2 (g);△H =+131.3kJ•mol-1
 (1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
V正、V逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
V正=V逆 |
|
II |
0.06 |
0.50 |
0.40 |
? |
|
III |
0.12 |
0.40 |
0.80 |
V正<V逆 |
|
IV |
0.12 |
0.30 |
? |
V正=V逆 |
 (2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和
1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25
倍。平衡时水蒸气的转化率为 ;向该容器中补充 a
mol 炭,水蒸气的转化率将
(填 “增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O),
最终容器中C16O和C18O 的物质的量之比为
。
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和
1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25
倍。平衡时水蒸气的转化率为 ;向该容器中补充 a
mol 炭,水蒸气的转化率将
(填 “增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O),
最终容器中C16O和C18O 的物质的量之比为
。

 (3)己知:C (s) +
(3)己知:C (s) + 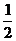 O2(g)=CO (g);△H = -110.5kJ·mo1-1
O2(g)=CO (g);△H = -110.5kJ·mo1-1
 CO(g) +
CO(g) + 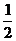 O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
O2(g) =CO2 (g);△H =-283.0 kJ·mo1-1
 H2 (g) +
H2 (g) + 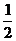 O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
O2 (g) =H2O (g);△H = -241.8kJ·mo1-1
 那么,将2.4
g 炭完全转化为水煤气,然后再燃烧,整个过程△H =
kJ·mo1-1
那么,将2.4
g 炭完全转化为水煤气,然后再燃烧,整个过程△H =
kJ·mo1-1
8、(12分)
(1)Ba(OH)2 + (NH4)2SO4 === BaSO4↓+2NH3↑+ 2H2O[ 2分,写(NH4)2SO3也可,BaSO4沉淀符号可以不写]
(2)Ca(HCO3)2 (2分);非极性(2分);极性键和非极性键(2分,只写一个得1分)
(3)Na2O2 Al2(SO4)3 (各2分)
8、(12分)
 A、B、C、D为中学化学常见的物质,其组成元素均为主族元素。它们间的反应关系如下图所示。
A、B、C、D为中学化学常见的物质,其组成元素均为主族元素。它们间的反应关系如下图所示。
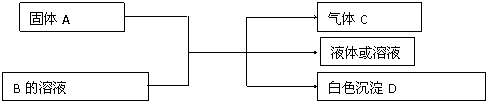
(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则A与B共热的化学方程式为 。
(2)若A是碳化钙(CaC2),B是一种盐,A与B的溶液反应时只生成气体C、CaCO3和水;则B的化学式为 ;C分子是 分子(填“极性”或“非极性”),所含共价键的类型为 。
(3)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液,A的相对分子质量与D相同。向一定量的B溶液中逐渐加入固体粉末A,当 A与B以物质的量之比3∶1反应时,生成的D的量最多。则A的化学式为 , B的化学式为 。
7.阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是( B )
 A.25℃时,1L pH=13的NaOH溶液中约含有6.02×1023个氢氧根离子
A.25℃时,1L pH=13的NaOH溶液中约含有6.02×1023个氢氧根离子

 B.室温下,42.0g乙烯和丙稀的混合气体中含有的碳原子数约为3×6.02×1023
B.室温下,42.0g乙烯和丙稀的混合气体中含有的碳原子数约为3×6.02×1023
 C.标准状况下,2.24L苯中约含有3.612×1023个碳原子
C.标准状况下,2.24L苯中约含有3.612×1023个碳原子
D.1.0L 1.0mol/L CH3COOH溶液中CH3COOH分子数为6.02×1023
6、下列离子方程式中正确的是(B )
A.氯化铁溶液与铁反应:Fe3+ + Fe = Fe2+
B.氯气与氢氧化钠溶液反应:2OH- + Cl2 = ClO- + Cl- + H2O
C.氯化铝溶液中加入过量氨水:Al3+ + 4NH3•H2O = AlO2-+ 4NH4+ +2H2O
D.碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3- + OH- = CO32-+ H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com