
1.(2006春上海) 若 ,则下列不等式成立的是( )
,则下列不等式成立的是( )
A. . B.
. B. .
C.
.
C.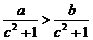 . D.
. D. .
.
2.不等式的性质:
(1)对称性: ,
, 
证明:(比较法)
(2)传递性: ,
,
(3)可加性: .
.
移项法则:
推论:同向不等式可加. 
(4)可乘性: ,
,
推论1:同向(正)可乘: 
证明:(综合法)
推论2:可乘方(正):
(5) 可开方(正):
证明:(反证法)
不等式的性质有五个定理,三个推论,一个比较原理,是解、证不等式的基础,对于这些性质,关键是正确理解和熟练运用,要弄清每一个条件和结论,学会对不等式进行条件的放宽和加强
1.比较原理:
两实数之间有且只有以下三个大小关系之一:a>b;a<b;a=b;
 ;
; ;
;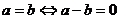 .
.
以此可以比较两个数(式)的大小,--作差比较法.
或作商比较:a>0时, ;a<0时,
;a<0时,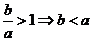 .
.
掌握不等式的性质及其证明,能正确使用这些性质解决一些简单问题
4、 在硫酸与硫酸铜的混合溶液200g中,滴入40%的氢氧化钠溶液100g恰好完全反应。记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示。问:(1)与硫酸铜反应的氢氧化钠溶液的质量为
g。(2)完全反应后,滤去沉淀物再将滤液倒入一个底面积为50cm2的圆柱形容器中,求容器底部受到的液体压强。(g=10N·kg-1,滤液损失忽略不计)(3)求所得溶液中溶质的质量分数。
在硫酸与硫酸铜的混合溶液200g中,滴入40%的氢氧化钠溶液100g恰好完全反应。记录反应过程,得到的沉淀与所加的氢氧化钠溶液的质量关系如图所示。问:(1)与硫酸铜反应的氢氧化钠溶液的质量为
g。(2)完全反应后,滤去沉淀物再将滤液倒入一个底面积为50cm2的圆柱形容器中,求容器底部受到的液体压强。(g=10N·kg-1,滤液损失忽略不计)(3)求所得溶液中溶质的质量分数。
3、 向盛有12.60g碳酸氢钠固体的烧杯中加入100.5g硫酸溶液恰好完全发生反应。反应过程中用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示。烧杯连同药品的起始质量为200.0g。反应的方程式为2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,回答下列问题:(1)当碳酸氢钠与硫酸溶液恰好完全反应时,所需时间约为
向盛有12.60g碳酸氢钠固体的烧杯中加入100.5g硫酸溶液恰好完全发生反应。反应过程中用精密仪器测得烧杯连同药品的质量(m)与反应时间(t)的关系如图所示。烧杯连同药品的起始质量为200.0g。反应的方程式为2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,回答下列问题:(1)当碳酸氢钠与硫酸溶液恰好完全反应时,所需时间约为
(2)当碳酸氢钠与硫酸溶液完全反应时,所产生二氧化碳的质量为
(3)反应后,所得硫酸钠溶液的溶质的质量分数为多少?
2、 研究性学习小组为了探究实验室中久置的氢氧化钠的变质程度。研究方案:先称取13.3g的氢氧化钠样品(杂质为碳酸钠),配成溶液,然后向溶液中逐滴滴加质量分数为14.6%的稀盐酸,根据生成的二氧化碳的质量测定碳酸钠的质量。从而进一步确定样品中氢氧化钠的变质程度。解决问题:实验测得加入稀盐酸的质量与生成二氧化碳的质量关系如图所示。
研究性学习小组为了探究实验室中久置的氢氧化钠的变质程度。研究方案:先称取13.3g的氢氧化钠样品(杂质为碳酸钠),配成溶液,然后向溶液中逐滴滴加质量分数为14.6%的稀盐酸,根据生成的二氧化碳的质量测定碳酸钠的质量。从而进一步确定样品中氢氧化钠的变质程度。解决问题:实验测得加入稀盐酸的质量与生成二氧化碳的质量关系如图所示。
填写下表:(计算结果保留小数点后一位)
|
碳酸钠的质量(g) |
|
|
变质氢氧化钠的质量(g) |
|
|
氢氧化钠的变质程度(用质量分数表示) |
|
继续探究:计算实验过程中与氢氧化钠反应消耗的盐酸的质量。
发现问题:根据“与氢氧化钠反应消耗的盐酸的质量”,对照图象,你发现了什么问题/
7、某样品为铜和氧化铜的混合物,现对其成分进行分析。取10g此样品,向其中分5次加入稀硫酸,使之充分反应。每次所用稀硫酸的质量及剩余固体质量记录于下表:
|
|
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
加入稀硫酸的质量(g) |
20 |
20 |
20 |
20 |
20 |
|
充分反应后剩余固体的质量(g) |
8 |
6 |
4 |
2 |
2 |
试回答下列问题:(1)10g样品中,氧化铜的质量分数为 g
(2)10g样品中,铜元素的质量总共为多少克?(3)足量稀硫酸与10g此样品完全反应后,可生成多少克硫酸铜?
 图象类:1、某同学在实验室中发现一瓶标签残缺的硫酸镁溶液。为了测定此溶液中溶质的质量分数,他取出25g该溶液,向其中逐滴滴加溶质质量分数10%的氢氧化钠溶液。反应过程中生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示。请计算此溶液的溶质的质量分数。
图象类:1、某同学在实验室中发现一瓶标签残缺的硫酸镁溶液。为了测定此溶液中溶质的质量分数,他取出25g该溶液,向其中逐滴滴加溶质质量分数10%的氢氧化钠溶液。反应过程中生成沉淀的质量与所用氢氧化钠溶液的质量关系如图所示。请计算此溶液的溶质的质量分数。

6、某校化学研究小组为了测定某氢氧化钙试样中氢氧化钙的含量(含有的杂质为碳酸钙),共做了三次实验,使一定的质量的该试样分别与同一种稀盐酸反应,所得相关实验数据记录如下表:
|
|
第一次 |
第二次 |
第三次 |
|
所取试样的质量 |
17.4 |
17.4 |
17.4 |
|
所取稀盐酸的质量 |
80 |
100 |
120 |
|
生成二氧化碳的质量 |
2.64 |
4.4 |
4.4 |
(1)在第 次实验中,反应容器中有白色粉末剩余。(2)原试样中氢氧化钙的质量分数(0.1%)(3)经测知,第二次实验反应完全后,所得溶液中溶质只有一种,通过计算求出实验中所取稀盐酸中溶质的质量分数(计算结果精确至0.1%)。
5、实验室购进了一批石灰石。某化学活动小组的同学利用稀盐酸测定该石灰石中碳酸钙的质量分数。他们取适量的石灰石研碎,然后分成两组开展实验。甲组利用电子天平每隔一段时间读取电子天平的读数。所测相关数据如下表:
|
甲组测量的项目 |
质量(g) |
|
锥形瓶及稀盐酸(过量) |
238.4 |
|
石灰石 |
12.0 |
|
混合反应物后第一次读数 |
249.3 |
|
第二次读数 |
248.2 |
|
第三次读数 |
246.0 |
|
第四次读数 |
246.0 |
(1)据甲组测量的有关数据,计算该石灰石中碳酸钙的质量分数(精确到0.1%)
(2)乙组也取12.0g石灰石与过量的稀盐酸反应,将生成的气体通入澄清的石灰水中,测量并记录石灰水反应前后质量的变化。你认为利用哪组同学测出的数据计算石灰石中碳酸钙的质量分数更可靠,说明理由。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com