
2.碳酸氢钠和碳酸钠的制法
(1)制取NaHCO 3的方法
①减压低温蒸干NaHCO3溶液。NaHCO3遇热易分解,其水溶液加热更易分解,所以不可能采用常压下蒸发溶剂的方法制得NaHCO3晶体。
②往饱和Na2CO3 溶液中通入CO2,过滤得到晶体。Na2CO 3+CO 2+H2O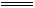 2NaHCO
3
2NaHCO
3
(2)联碱法制纯碱原理
①在饱和食盐水中通 饱和后,再通 :NH3+CO2+H2O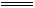 NH4HCO3
NH4HCO3
②生成NH4HCO3的溶解度大,而c(Na+)也大,而NaHCO3溶解度小,故产生沉淀:NaCl+ NH4HCO3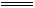 NaHCO3↓+NH4Cl,总方程式:
。
NaHCO3↓+NH4Cl,总方程式:
。
③将析出沉淀加热,制得Na2CO3(纯碱)
|
[特别提醒]:不能先通入CO2达饱和后再通入NH3,因为CO2在水中的溶解度很小(1∶1),即使通入过量的NH3,所生成的NaHCO3、NH4Cl也很少,这样就无法制取NaHCO3。 |
[例3] 下列实验能成功的是 ( )
①用水鉴别Na2CO3和NaHCO3固体;②用观察法区别Na2O和Na2O2;③用MgCl2溶液鉴别Na2CO3溶液和NaOH溶液;④用稀盐酸鉴别Na2CO3溶液和NaHCO3溶液。
A.①②③④ B.①② C.②③ D.①②④
[解析]Na2CO3溶解度远大于NaHCO3,取等量水,溶解得多的固体就是Na2CO3。Na2CO3还能与水结合成块状Na2CO3·10H2O,分别取a g固体,各加b mL的水,搅拌,有溶液的为NaHCO3,只形成块状固体的为Na2CO3。Na2O呈白色,Na2O2为黄色,观察即可分辨。MgCO3与Mg(OH)2都难溶于水,故MgCl2溶液不能区别Na2CO3溶液和NaOH溶液。Na2CO3溶液与稀盐酸反应的现象随操作不同而不同,Na2CO3溶液滴入稀盐酸中,立即产生气泡;而将稀盐酸滴入Na2CO3溶液中,先发生反应CO32-+H+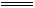 HCO3-,没有立即产生气泡,当CO32-完全转化成HCO3-后再滴盐酸,即相当于在NaHCO3溶液中加稀盐酸,立即产生气泡,所以向未知液中逐滴加稀盐酸的方法可区别Na2CO3溶液和NaHCO3溶液。
HCO3-,没有立即产生气泡,当CO32-完全转化成HCO3-后再滴盐酸,即相当于在NaHCO3溶液中加稀盐酸,立即产生气泡,所以向未知液中逐滴加稀盐酸的方法可区别Na2CO3溶液和NaHCO3溶液。
[答案]D
[黑色陷阱]本题不仅要考虑物质的性质差异,而且要考虑操作方法的不同对差异性质的影响。Na2CO3、NaHCO3溶液滴入到盐酸中的现象是一致的,而稀盐酸滴入这两种溶液中产生气泡是后者快。因忽略了NaHCO3比Na2CO3与酸反应激烈而误选B。
考点4 碱金属
1.碳酸钠、碳酸氢钠主要性质比较及鉴别
(1)热稳定性不同。分别加热少量固体,若发生分解反应,将产生的气体通入澄清的石灰水中,石灰水变浑浊的原试剂是 ,另一个为 。
(2)和酸反应速率不同。分别取一定质量的固体,加入等浓度、等体积的盐酸,反应快、产生气体多的为 ,另一个为 。
(3)阴离子不同。分别取其稀溶液,滴加氯化钡稀溶液或CaCl2溶液,产生沉淀的原试剂为 ,另一个为 。
(4)溶液的酸碱性。测其稀溶液(0.1 mol·L-1)的pH, 溶液的pH在12左右,而
溶液的pH在8左右。
|
[特别提醒]:碳酸钠溶液与盐酸反应时,二者滴加的次序不同,产生的现象不同。 向盐酸中逐滴加入Na2CO3溶液(开始时酸过量):2HCl+Na2CO3 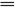 2NaCl+CO2↑+H2O。若向Na2CO3溶液中逐滴加入盐酸(开始时酸不足):HCl+Na2CO3 2NaCl+CO2↑+H2O。若向Na2CO3溶液中逐滴加入盐酸(开始时酸不足):HCl+Na2CO3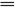 NaCl+NaHCO3(无气泡),HCl+NaHCO3 NaCl+NaHCO3(无气泡),HCl+NaHCO3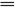 NaCl+CO2↑+H2O。由以上分析可知,不同的滴加顺序产生不同的现象,这就是不用其他试剂鉴别Na2CO3溶液和盐酸的原理。 NaCl+CO2↑+H2O。由以上分析可知,不同的滴加顺序产生不同的现象,这就是不用其他试剂鉴别Na2CO3溶液和盐酸的原理。 |
2.Na2O2的性质
-1价介于氧的两种较稳定化合价0价和-2价之间,因此Na2O2既可以在一定条件下
获得电子表现 (如与SO2、Fe2+、品红等反应),也可以在一定条件下失去电子
表现 (如与H+和MnO4-反应),还可以在一定条件下发生歧化反应(如与H2O、CO2等反应);但以 为主。
Na2O2与SO2反应:Na2O2+SO2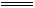
Na2O2投入FeCl2溶液中,可将Fe2+氧化成Fe3+,同时生成Fe(OH)3沉淀: 。
Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液变浑浊: 。
Na2O2投入品红溶液中, 使品红溶液褪色(褪色原理与SO2 )。
[特别提醒]:Na2O2跟CO2和水蒸气组成的混合气体反应时的先后顺序。若先发生反应:2Na2O2+2H2O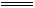 4NaOH+O2↑,必还发生2NaOH+CO2 4NaOH+O2↑,必还发生2NaOH+CO2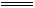 Na2CO3+H2O,即应先考虑Na2O2跟CO2的反应。 Na2CO3+H2O,即应先考虑Na2O2跟CO2的反应。 |
[例2](2006年全国Ⅰ)在呼吸面具和潜水艇中可用过氧化纳作为供氧剂。请选用适当的化学试剂和实验用品、用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。
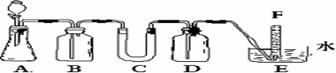
(1)A是制取CO2的装置。写出A中发生反应的化学方程式: 。
(2)填写表中空格:(请在答题卡上填空)
|
仪器 |
加入试剂 |
加入该试剂的目的 |
|
B |
饱和NaHCO3溶液 |
|
|
C |
|
|
|
D |
|
|
(3)写出过氧化钠与二氧化碳反应的化学方程式: 。
(4)试管F中收集满气体后,下一步实验操作是: 。
[解析]要证明过氧化钠可作供氧剂,必须验证实验产物是O2,故实验目的就是验证过氧化钠与水或二氧化碳的反应。实验仪器中的A是二氧化碳发生装置,B、D是除杂装置,C是反应装置,E是尾气处理与收集装置。本实验可能存在的杂质气体有:HCl和水,但由于过氧化钠与二氧化碳的反应是离子反应,故水不必除去。试管F中收集满气体后,下一步实验操作应是验证实验产物是O2。为检验生成的O2应将试管F从水槽中取出,然后用带火星的木条伸入管口进行检验,但是取出F前,应将装置A中的反应停止。
[答案](1)CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)B 饱和NaHCO3 除CO2中的HCl
C Na2O2粉末 反应物
D NaOH溶液 除去未反应的CO2
(3)2Na2O2+2CO2=2Na2CO3+O2 (4)将带火星的木条插入试管检验木条能否复燃。
[方法技巧]做实验首先确立实验目的,确定装置B、C、D的作用是解答本题的关键。易错点是部分考生考虑二氧化碳中的水必须除去,从而认为装置是干燥装置,D是Na2O2与CO2反应装置而出现错误。
考点3 碳酸钠、碳酸氢钠
1.Na2O2的结构特点
在Na2O2和H2O2中,氧是 价,这是因为两个氧原子之间以一对共用电子相结合(非极性键),形成了一种不太稳定的结构。
3.钠与盐溶液的反应
实质上是先与水反应生成 NaOH,NaOH再与盐反应。
与CuSO4溶液反应:2Na+2H2O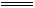 NaOH+H2↑
(1) CuSO4+2NaOH
NaOH+H2↑
(1) CuSO4+2NaOH Na2SO4
Na2SO4
+Cu(OH)2 (2) 合并(1)(2)得:
(2)与FeCl3溶液反应:
|
[特别提醒]:钠和盐溶液反应,不能置换出盐中的金属,这是因为金属阳离子在水中一般是以水合离子形式存在,即金属离子周围有一定数目的水分子包围着,不能和钠直接接触。钠与熔融的盐反应才可能置换出盐中的金属。 |
[例1] 下列关于钠与水反应的说法不正确的是 ( )
①将小块钠投入滴有石蕊试液的水中,反应后溶液变红;②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应;③钠在水蒸气中反应时因温度高会发生燃烧;④将两小块质量相等的金属钠,一块直接投入水中,另一块用锡箔包住,在锡箔上刺些小孔,然后按入水中,两者放出的氢气质量相等。
A.①② B.②③ C.②③④ D.①②③④
[解析]钠与水反应产生氢氧化钠只能使酚酞变红,而不能使石蕊变红。钠与水的反应本质是钠与H+的反应,所以钠先与盐酸溶液中的酸反应。钠在水蒸气中反应产生的是氢气,尽管温度高且反应放热,因无氧气不能燃烧。钠的密度比水大,浮在水面上时,就有部分钠被氧气氧化,而用锡箔包住的钠不会被氧气氧化,所以与水反应的钠质量不相等,两者放出氢气的质量也不相等。
[答案]D
[黑色陷阱]忽视了钠与水反应产生H2,无氧气存在而漏选③;忽略了钠直接投入水中,在水面上部分钠被氧化而漏选④。
考点2 过氧化钠的结构与性质
2.钠与酸溶液反应
当钠投入酸溶液中,钠首先与酸电离出的H+反应: ;当酸完全反应后,过量的钠再与水反应,故钠与酸溶液反应比钠与水反应 。
1.钠与水的反应可以概括为: 五个字来记忆。
(1)钠投入水中并浮在水面上--密度 水。
(2)钠立即跟水反应,并 ,发出嘶嘶声,产生气体。
(3)同时钠熔成一个闪亮的小球并在水面上向各方向迅速游动最后消失-- 。(4)反应后的水溶液使酚酞 --与水反应生成NaOH。
完成课后练习题三。
这篇记实报道以平实的语言,真实地记录了人类首次登月的全过程,表达了作者对登月成功后的喜悦之情以及对人类聪明才智的赞叹。本文按照事情发展的时间顺序来记叙,条理十分清晰,记叙的要素交代得一目了然,且语言平实、准确,体现了新闻报道的准确性、真实性、科学性。
2.阿姆斯特朗谈到登月的意义时说:“这一小步,对于一个人来说,是小小的一步;对整个人类来说,是巨大的飞跃。”你是怎样理解的?
(先让学生畅所欲言,教师稍作归纳。“一小步”是指宇航员们从飞船跨到月球表面的一小步,对一个人来讲确实很容易,毫不费力。但是这一步是人类向太空领域迈出的第一步,它显示了人类卓越的聪明才智,表明了人类高度发达的科技水平,开创了人类对宇宙探索的新纪元,这意义就非同小可,因此说这是巨大的飞跃。
人类第一次成功地探访月球已是三十一年前的事了。时光飞逝,时至今日,人类向宇宙迈进的步伐从没停止过,你知道人类探索宇宙奥秘的其他成果吗?
让学生谈谈,互通有无,增长见识,激发学生爱科学、学科学、用科学的兴趣。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com