
10.(广东省实验中学2008学年高三第二次阶段测试试卷 )下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的( BC )
A.将NaHCO3固体加入新制氯水,有无色气泡(H+)
B.使红色布条褪色(HCl)
C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(HCl)
D.滴加AgNO3溶液生成白色沉淀(Cl-)
9、(广东漳州市芗城中学高三年10月考)(6分)近年来,我国对储氢纳米碳管的研究获得了重大进展,电弧法合成的纳米碳管常伴有大量物质--碳纳米颗粒。这种碳纳米颗粒可用氧化法提纯。其反应的化学方程式为:
□C +□K2Cr2O7 +□H2SO4(稀)=== □CO2+□K2SO4+□Cr2(SO4)3+□
(1)完成并配平上述反应的化学方程式。
(2)此反应的氧化剂是 ,氧化产物是 。
(3)H2SO4在上述反应中表现出来的性质是 。
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应中若产生11g气体物质,则转移的电子数目为 。
答案:
(1)3C+2K2Cr2O7+8H2SO4===3CO2+2K2SO4+2Cr2(SO4)3+8H2O(2分)
(2)K2Cr2O7 CO2(各1分)
(3)A (1分)
(4)6.02×1023(1分)
8、(广东漳州市芗城中学高三年10月考)(9分)5·12汶川大地震后在灾区使用了多种消毒剂,高锰酸钾是其中之一。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
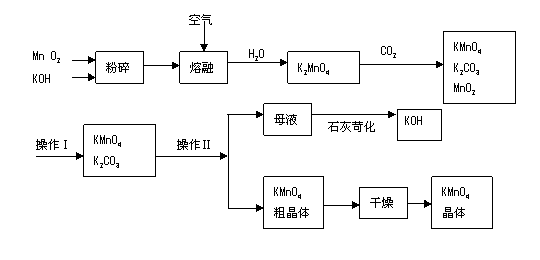
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质相同的是______(填代号)。
A.84消毒液(NaClO溶液) B.双氧水 C.苯酚 D.75%酒精
(2)高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
A.浓硝酸 B.硝酸银 C.氯水 D.纯碱
(3)上述流程中可以循环使用的物质有______________、______________(写化学式)。
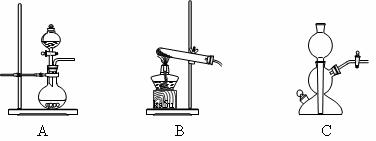
(4)该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2所需试剂最好选择___________(选填代号)。
A.石灰石 B.稀HCl C.稀H2SO4 D.纯碱
所需气体发生装置是_____________(选填代号)。
(5)操作Ⅰ的名称是_____________;操作Ⅱ是根据KMnO4和K2CO3两物质在__________(填性质)上的差异,采用__________________(填实验操作步骤)、趁热过滤得到KMnO4粗晶体的。
答案:
(1)AB(各1分)
(2)D;
(3)MnO2 KOH;
(4)CD A;
(5)过滤 溶解度 浓缩结晶(少“浓缩”不给分)。
7、(广东漳州市芗城中学高三年10月考)写出下列反应的化学方程式:
(1)Br2在加热的情况下跟氢氧化钠溶液反应生成溴化钠、溴酸钠(NaBrO3)和水,化学方程式为:
__。
(2)氯胺(NH2Cl)在中性或酸性条件下是一种强消毒杀菌剂,常用于城市自来水杀毒。根据水解原理你认为主要发生的化学反应方程式为: 。
(3)氯酸是一种强酸,当氯酸溶液中氯酸的质量分数超过40%时,它会迅速分解,产生一种比它酸性更强的酸,同时放出a,b两种气体,其中a能使余烬的木条复燃;b能使润湿的碘化钾试纸变蓝;而且a与b的物质的量之比为15:8 。根据以上事实写出氯酸分解的化学反应方程式:
__。
6、(广东漳州市芗城中学高三年10月考)(1)配平下列离子反应方程式:
Fe(OH)3+ ClO-+ OH- === FeO4n-+ Cl-+ H2O
(2)已知有3.21gFe(OH)3参加反应,共转移了5.4×1022个电子,则n= ,FeO4n-中铁元素的化合价为 。
(3)根据(1)、(2)推测,FeO4n-能和下列 (填序号)物质反应。
A.KMnO4 B.SO2 C.H2S D.O2
5、(广东漳州市芗城中学高三年10月考)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应生成MnSO4、K2SO4、H2O和O2
(1)写出该氧化还原反应的化学方程式:___________________________________________________。
(2)反应中氧化剂是________;被氧化的元素是__________;若有0.5 mol H2O2参加此反应,电子转移个数为_________。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为:
_______________________________;这时若有0.5 mol H2O2发生分解,电子转移个数为_____________。
4、(广东漳州市芗城中学高三年10月考)在Cu2S+2Cu2O===6Cu+SO2↑反应中,说法正确的是
A.Cu2S在反应中既是氧化剂,又是还原剂
B.Cu是氧化产物
C.氧化剂只有Cu2O
D.生成1mol Cu,反应中转移2mol电子
2.(广东省梅州市曾宪梓中学2009届高三11月月考 )根据下表信息,下列叙述中正确的是( C )
|
序号 |
氧化剂 |
还原剂 |
其他反应物 |
氧化产物 |
还原产物 |
|
① |
Cl2 |
FeBr2 |
|
|
Cl- |
|
② |
KMnO4 |
H2O2 |
H2SO4 |
O2 |
Mn2+ |
|
③ |
KClO3 |
浓盐酸 |
|
Cl2 |
|
|
④ |
KMnO4 |
浓盐酸 |
|
Cl2 |
Mn2+ |
A.表中①组反应的氧化产物只能有FeCl3
B.氧化性强弱比较:KMnO4>Fe3+>Cl2>Fe2+
C.④的离子方程式配平后,H+的化学计量数为16
D.表中③还原产物是KCl
3、(广东漳州市芗城中学高三年10月考)下列反应中,盐酸既表现出酸性又表现出氧化性的是
A.MnO2+4HCl(浓) △ MnCl2+Cl2↑+2H2O
B.HCl+AgNO3===AgCl↓+HNO3
C.Zn+2HCl ===ZnCl2+H2↑
D.2HCl通电 H2↑+Cl2↑
2.用含Na2CO3的NaOH标准液滴定盐酸。
分析:若以酚酞作指示剂,由于1 mol HCl~40 g NaOH而1 mol HCl~106 g Na2CO3~80 g NaOH,所以这实际上相当于V(NaOH)变大了,最终导致c盐酸的值偏大。
试题枚举
[例1] 有①②③三瓶体积相等、浓度都是1 mol·L-1的HCl溶液,将①加热蒸发至体积减少一半,在②中加入少量CH3COONa固体(加入后溶液仍呈强酸性),③不作改变,然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所消耗的NaOH溶液的体积是( )
A.①=③>② B.③>②>①
C.③=②>① D.①=②=③
解析:这是一道有关化学实验、酸碱中和滴定、电离平衡移动、盐类水解等的综合题。“陷阱”设在①中,蒸发时溶液中的水分子和HCl分子将同时挥发出来,溶液中盐酸浓度要降低;对于②中加入CH3COONa固体,CH3COO-+H+ CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中和,所以消耗NaOH的体积不会变化。
CH3COOH,但用NaOH溶液中和时,CH3COOH也同时被中和,所以消耗NaOH的体积不会变化。
答案:C
[例2] 取相同体积(0.025 L)的两份0.01 mol·L-1 NaOH溶液,把其中一份放在空气中一段时间后,溶液的pH_________(填“增大”“减小”或“不变”),其原因是_________。
用已知浓度的硫酸溶液中和上述两份溶液,其中第一份(在空气中放置一段时间)所消耗硫酸溶液的体积为V(A),另一份消耗硫酸溶液的体积V(B),则:
(1)以甲基橙为指示剂时,V(A)和V(B)的关系是:_________;
(2)以酚酞为指示剂时,V(A)和V(B)的关系是:_________。
解析:NaOH溶液放置于空气中,因NaOH与空气中CO2反应造成NaOH减少,故溶液的pH减小。用H2SO4滴定Na2CO3溶液,反应分两个阶段进行:
①H++CO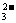 ====HCO
====HCO (此时溶液呈弱碱性)
(此时溶液呈弱碱性)
②H++HCO ====CO2↑+H2O(此时溶液呈弱酸性)
====CO2↑+H2O(此时溶液呈弱酸性)
滴定过程中,按哪种反应进行,取决于选择的指示剂。
(1)若选用甲基橙作指示剂,因其变色范围在pH=3.1-4.4。故滴定反应按②进行,由关系式:2NaOH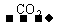 Na2CO3
Na2CO3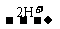 CO2↑可知消耗的H2SO4量不变,故答案为V(A)=V(B)。
CO2↑可知消耗的H2SO4量不变,故答案为V(A)=V(B)。
(2)若选用酚酞作指示剂,酚酞的变色范围为pH=8-10,滴定反应按①进行,由关系式:2NaOH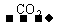 Na2CO3
Na2CO3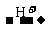 NaHCO3可知消耗H2SO4的量减少,故答案为V(A)<V(B)。
NaHCO3可知消耗H2SO4的量减少,故答案为V(A)<V(B)。
答案: 减小因NaOH与空气中CO2反应,造成NaOH减少,故溶液pH减小
(1)V(A)=V(B)
(2)V(A)<V(B)
[例3]测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。 将沉淀用稀硫酸处理得H2C2O4后,再用KMnO4某酸性溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·
L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式_______________________。
(2)判断滴定终点的方法是________________________________________。
(3)计算:血液中含钙离子的浓度为________________________________g·mL-1。
解析:因为KMnO4溶液至反应完毕过量时,会使溶液呈紫色,故可用滴入一滴KMnO4酸性溶液由无色变为浅紫色且半分钟不褪色的方法来判断终点。由题意知可能发生反应的离子方程式为:2MnO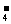 +5H2C2O4+6H+====2Mn2++10CO2↑+8H2O、Ca2++C2O
+5H2C2O4+6H+====2Mn2++10CO2↑+8H2O、Ca2++C2O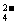 ====CaC2O4↓、CaC2O4+2H+====Ca2++H2C2O4。
====CaC2O4↓、CaC2O4+2H+====Ca2++H2C2O4。
设2 mL血液中含Ca2+的物质的量为x,则
5Ca2+-5CaC2O4-5H2C2O4-2MnO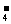
5 2
x 20.0×10-3 L×1.0×10-4 mol·L-1
x=5.0×10-6 mol,1 mL血液中Ca2+的浓度为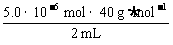 =1.0×104 g·mL-1
=1.0×104 g·mL-1
答案: (1)2MnO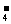 +5H2C2O4+6H+====2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+====2Mn2++10CO2↑+8H2O
(2)溶液由无色变为浅紫色,且半分钟内不褪色
(3)1.0×10-4
用固体配制标准液时,样品中含有杂质。
1.用盐酸滴定含Na2O的NaOH样品。
分析:由于1 mol HCl~40 g NaOH,而1 mol HCl~31 g Na2O,所以实际上相当于NaOH质量变大了,最终使w(NaOH)的值偏大。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com