
22、(广东雷州二中09第三次月考化学试题 )近日来,质检部门在众多品牌乳制品中检出有毒有机物三聚氰胺[C3N3(NH2)3],在乳制品行业掀起了一场轩然大波,引发了一场关于食品安全问题的大讨论。三聚氰胺是一种重要的有机化工原料,因其含氮量高而被不法商家用作食品添加剂,以提升食品检测中的蛋白质含量指标(N%),因此三聚氰胺也被人称为“蛋白精”。三聚氰胺遇强酸或强碱水溶液水解,胺基逐步被羟基取代,最后生成三聚氰酸[C3N3(OH)3]。三聚氰酸可用于消除汽车尾气中的NO2。其反应原理为:C3N3(OH)3 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 7N2+8CO2+4H2O,下列说法正确的是
A、C3N3(OH)3与HNCO为同一物质
B、HNCO是一种很强的氧化剂
C、1mol NO2在反应中转移的电子为4mol
D、反应中NO2是还原剂
7N2+8CO2+4H2O,下列说法正确的是
A、C3N3(OH)3与HNCO为同一物质
B、HNCO是一种很强的氧化剂
C、1mol NO2在反应中转移的电子为4mol
D、反应中NO2是还原剂
21.(广东雷州二中09第三次月考化学试题 )有一未完成的离子方程式为□ +XO3-+6H+==3X2+3H2O,据此判断,X元素的最高化合价为
A.+1 B.+4 C.+5 D.+7
20. (2009届汕头市龙湖区第二次高三化学联考)(7分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。已知钒的原子序数为23,试回答下列问题:
(2009届汕头市龙湖区第二次高三化学联考)(7分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。已知钒的原子序数为23,试回答下列问题:
(1)钒在元素周期表位于第________周期,第________族。
(2)钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的化学式为K2H6U2V2O15(其中钒元素的化合价为+5价)。若用氧化物的形式表示,该化合物的化学式为_______________________。
(3)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒。请配平下列反应的化学方程式:
_______VO2++_______H2C2O4→_______VO++_______CO2+_______H2O
(4)工业上由V2O5 冶炼金属钒常用铝热剂法。试用化学方程式表示出来:___________________________________________________________________________________________________________。
答案:
(1)四 , VB (2分)
(2)K2O·V2O5·2UO3·3H2O(2分,不必考虑物质的排列顺序)
|
(4)3V2O5+10Al ==== 6V+5Al2O3(1分)
19.(2009届汕头市龙湖区第二次高三化学联考)F2和Xe在一定条件下可生成氧化性极强且
极易水解的XeF2、XeF4和XeF6三种化合物。如XeF4与水可发生如下反应:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。下列判断中正确的是
A.XeF2分子中各原子均达到八电子结构
B.XeF6分子中Xe的化合价为+6价
C.上述反应中氧化剂和还原剂的物质的量之比为1∶2
D.XeF4按已知方式水解,每生成4molXe,转移12mol电子
18.(2009届汕头市龙湖区第二次高三化学联考).漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的
离子方程式为:5HClO2 = 4ClO2↑+ H+ + Cl- + 2H2O。向NaClO2溶液中滴加H2SO4,开始反
应缓慢,随后反应迅速,其原因是
A.在酸性条件下亚氯酸的氧化性增强 B.溶液中的H+起催化作用
C.ClO2逸出,使反应的生成物浓度降低 D.溶液中的Cl-起催化作用
16.(潮州市金山中学高三化学08年10月考试)羟胺(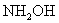 )是一种还原剂.现用
)是一种还原剂.现用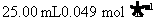 的羟胺的酸性溶液跟足量的
的羟胺的酸性溶液跟足量的 溶液在煮沸条件下反应,生成
溶液在煮沸条件下反应,生成 离子恰好与
离子恰好与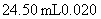
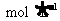 的酸性
的酸性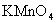 溶液完全作用生成
溶液完全作用生成 ,
,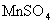 等物质,则上述反应中羟胺的氧化产物是( B )
等物质,则上述反应中羟胺的氧化产物是( B )
A. B.
B. C.NO D.
C.NO D.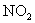
17 (广东省中山一中09届高三第一次统测 ) 物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液.由于浓度不同而能发生不同氧化反应的是:
A.①③ B.③④ C.①② D.①③④
15.(潮州市金山中学高三化学08年10月考试)(12分)
(1)在热的稀硫酸溶液中溶解了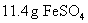 .当加入
.当加入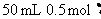
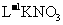 溶液后,使其中的
溶液后,使其中的 全部转化成
全部转化成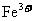 ,
,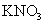 也反应完全,并有
也反应完全,并有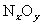 氮氧化物气体逸出.
氮氧化物气体逸出.
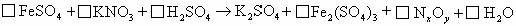
① 推算出x=________,y=________.
②配平该化学方程式(系数填写在上式方框内)
③反应中氧化剂为________.
④用短线和箭头标出电子转移的方向和总数.
(2)油画所用颜料含有某种白色的铅化合物,置于空气中,天长日久就会生成黑色PbS,从而使油画的色彩变暗,若用 来“清洗”,则可将PbS转变为白色的
来“清洗”,则可将PbS转变为白色的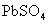 而使油画“复原”.请填空:
而使油画“复原”.请填空:
①上述“清洗”反应的化学方程式为________________________________.
②若有0.1 mol的PbS参加反应,则在此反应中发生转移的电子为________mol.
答案:
.(共12分)
(1)①x=1,y=1;(2分)
②6、2、4=1、3、2、4;(2分)
③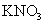 (2分)
(2分)
④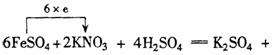
 (2分)
(2分)
(2)PbS+4H2O2=PbSO4+4H2O(2分); 0.8(2分)
14.(8分) 白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。
(1)白磷是_______晶体,31g白磷与足量的氧气完全燃烧释放出745.5kJ的热量,请写出白磷燃烧的热化学反应方程式:_________________________________________;
(2)已知白磷和氯酸溶液可发生如下反应:
P4 + HClO3 + === HCl + H3PO4
配平并完成上述反应方程式,该反应的氧化剂是______________。
(3)白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O === 20Cu3P + 24 H3PO4 + 60 H2SO4
该反应的氧化产物是______________,若有1.1mol P4反应,则有________mol电子转移。
答案:
.(8分) (1) 分子(1分) P4(s) + 5O2(g)
=== 2P2O5(s); kJ/mol(2分)
kJ/mol(2分)
(2) 3 P4 + 10 HClO3 + 18 H2O = 10 HCl + 12 H3PO4(2分) ;HClO3 (1分)
(3) H3PO4(1分) ;12(1分)
13.(广东省广州六中2009届高三第一次月考测试卷)北京市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20-50 mg/kg |
|
分装日期 |
|
|
分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是________________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及上述步骤中的位置是____________________________________。
(3)已知:I2+2S2O32 - = 2I-+S4O62 -。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是__________________________________________。
②b中反应所产生的I2的物质的量是________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)________________mg/kg。
答案:
.(1)1、5、3、3、3、3。
(2)①I2+SO32 -+H2O = 2I-+SO42 -+2H+;②在步骤b后,增加操作:将分液漏斗充分振荡后静置。
(3)①溶液由蓝色恰好变为无色。 ②1.0×10-5。
③ 。
。
11.(广东省实验中学2008学年高三第二次阶段测试试卷 )向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计,则下列说法中正确的是( B )
A.原溶液的浓度为0.1mol/L B.反应后溶液中c(Fe3+)=0.1mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+) D.原溶液中c(Br-)=0.4mol/L
12 (广东省六校2009届高三第二次联考试卷)海底黑烟囱可在海底堆积硫化物的颗粒,形成多种金属矿产。若从海底黑烟囱附近的矿产物中分离出富铜矿CuFeS2,可用于冶炼铜,熔炼过程主要反应为:
2CuFeS2 = Cu2S+2FeS+S…………………………… ①
2Cu2S+3O2=2Cu2O+2SO2………………………………… ②
Cu2O+FeS = Cu2S+FeO……………………………… ③
2FeS+3O2+SiO2 = 2FeO·SiO2+2SO2………………… ④
2FeO+SiO2 = 2FeO·SiO2……………………………… ⑤
Cu2S+2Cu2O = 6Cu +SO2 ……………………………… ⑥
下列有关说法不正确的是
A.上述反应均属于氧化还原反应 B.该厂可同时建硫酸厂和炼铁厂
C.该厂的原料除富铜矿外,还需空气和硅石 D.反应④转移12e-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com