
2.函数f(x)=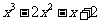 的零点是( )
的零点是( )
A. 1,2,3 B.-1,1,2 C.0,1,2 D.-1,1,-2
1.函数f(x)=x- 的零点是( )
的零点是( )
A.0 B.1 C.2 D.无数个
14.资料显示:“氨气可在纯氧中安静燃烧……某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
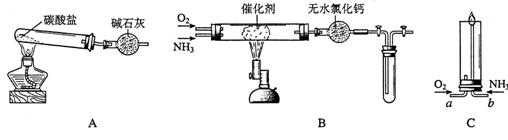
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是 ;碱石灰的作用是 。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式是
试管内气体变为红棕色,该反应的化学方程式是
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中。试管内气体颜色变浅,请结合化学方程式说明原因
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通人到装置C中,并在b管上端点燃氨气:
①两气体通入的先后顺序是
其理由是
②氨气燃烧的化学方程式是
13.用实验确定某酸HA是弱电解质。两同学的方案:
甲:①称取一定质量的HA配制0.1mo1·L-1的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用的定量仪器是 。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填“>”“<”“=”)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
a.装HCl溶液的试管中放出H'的速率快;
b.装HA溶液的试管中放出H2的速率快;
c.两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处 。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作扼要表述。
12.为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去,再与溴水反应。请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式 。
(2)甲同学设计的实验 (填能或不能)验证乙炔与溴发生加成反应,其理由是 (多选扣分)。
A.使溴水褪色的反应,未必是加成反应 B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙炔 D.使溴水褪色的物质:就是乙炔
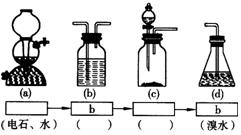
(3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的化学方程式是 ;在验证过程中必须全部除去。
(4)请你选用右边四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性。理由是 。
11.(1)甲同学向品红溶液通入一种气体后,品红溶液褪色,乙同学设计了一个很简单的实验便知甲同学通的是C12,还是S02,乙同学的实验方案是什么?
(2)将H202溶液滴入含有酚酞的Na0H溶液中,红色消失,甲同学认为这是由于H202是二元弱酸(H202  H+ +H02-)消耗了OH-而使红色褪去。乙同学认为H202具有强氧化性将酚酞氧化的结果,设计一个实验证明、甲乙同学的假设谁正确?
H+ +H02-)消耗了OH-而使红色褪去。乙同学认为H202具有强氧化性将酚酞氧化的结果,设计一个实验证明、甲乙同学的假设谁正确?
10.(1)在试剂车间,技术员提出了制备氢氧化铝的三种工艺过程:
第一种  A13+
A13+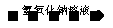 A1(OH)3
A1(OH)3
第二种 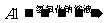 A1O2-
A1O2- (OH)3
(OH)3
|

 第三种
第三种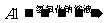 A1O2-
A1O2-
 A13+
A13+
试从成本、环保达标等方面评价,第 种最优。
(2)根据市场的需求,厂长请学生设计开发胆矾产品的方案。学生们设计了以下三种
方案:
方案甲: 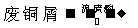 CuSO4
CuSO4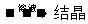 CuSO4·5H2O
CuSO4·5H2O
方案乙:  SuO4
SuO4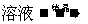 CuSO4·5H2O
CuSO4·5H2O
方案丙: 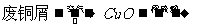 CuSO4
CuSO4 CuSO4·5H2O
CuSO4·5H2O
则合理可行的方案为 。
9.用下面两种方法可以制得白色的Fe(OH)2沉淀。方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。(1)用硫酸亚铁晶体配制上述溶液时还需加入
(2)除去蒸馏水中溶解的O2常采用 的方法。
 (3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
 方法二:如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
方法二:如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管I里加入的试剂是 。(2)在试管Ⅱ里加入的试
剂是 。(3)为了制得白色Fe(0H)2沉淀,在试管I和
Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是
(4)这样生成的Fe(0H)2
沉淀能较长时间保持白色,其理由是
8.已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。
|
序号 |
实验步骤 |
简述实验操作 (不必叙述如何组装实验装置) |
|
① |
溶解 |
将混合物放入烧杯中,加入98%H2SO4,充分搅拌直到固体不再溶解 |
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
|
⑥ |
检验沉淀 是否洗净 |
|
7. 氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+3H20+N2)而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即反应生成Mg(OH)2和NH3。下面是甲、乙两位学生提出的制备氮化镁的两种方案示意框图(实验前系统内的空气已排除;图中箭头表示气体的流向)。
氨跟氧化铜反应可以制备氮气(2NH3+3CuO 3Cu+3H20+N2)而氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即反应生成Mg(OH)2和NH3。下面是甲、乙两位学生提出的制备氮化镁的两种方案示意框图(实验前系统内的空气已排除;图中箭头表示气体的流向)。

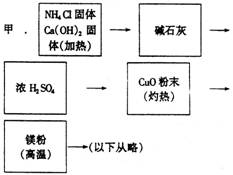
填空和回答问题
(1)甲、乙两生的实验方案是否能制得氮化镁?(填“能”或“不能”)甲 乙 。
(2)具体说明不能制得氮化镁的原因(如两个方案都能制得氮化镁,此小题不用回答)。
答:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com