
7、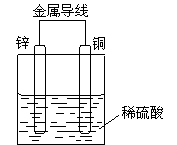 关于如图所示装置的叙述,正确的是
关于如图所示装置的叙述,正确的是
A. 铜是正极,铜片上有气泡产生
B. 铜片质量逐渐减少
C. 电流从锌片经导线流向铜片
D. 该装置能将化学能转化为电能
6、下列现象与电化学理论有关的是
A.氧化铝膜破坏后,金属铝被迅速氧化
B.白铁镀锌层破损后,还能阻止铁被氧化
C.纯锌与稀硫酸反应时,滴少量硫酸铜溶液后速率加快
D.铁丝在氯气中燃烧产生大量棕黄色的烟
5、下列叙述中,不能说明金属甲比金属乙的活泼性强的是( )
A、在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多。
B、同价态的阳离子,甲比乙的氧化性强。
C、甲能从铜盐溶液中置换出铜,而乙不能置换出铜。
D、甲、乙的单质与稀硫酸组成原电池,甲作为原电池的负极。
4、为了避免青铜器生成铜绿,以下方法正确的是( )
(A)将青铜器放在银质托盘上 (B)将青铜器保存在干燥的环境中
(C)将青铜器保存在潮湿的空气中 (D)在青铜器的表面覆盖一层防渗的高分子膜
3、氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括( )
A、原料来源广 B、易燃烧、热值高 C、储存方便 D、制备工艺廉价易行
2、下列氧化还原反应中,水不是作为氧化剂的是( )
(A)CO+H2O CO2+H2 (B)3NO2+H2O = 2HNO3+NO
CO2+H2 (B)3NO2+H2O = 2HNO3+NO
(C)2Na2O2+2H2O = 4NaOH+O2↑ (D)2F2+2H2O = 4HF+O2
1、下列做法中不是利用氧化还原反应原理的是( )
A.明矾净化水 B.纯碱除去油污
C.臭氧消毒餐具 D.食醋清洗水垢
3、金属的防护方法
①覆盖保护膜(涂油漆,电镀,钝化等):在金属的表面添加防护层,以隔绝金属与氧化性较强的、能引起金属腐蚀的物质接触。
②改变金属的内部结构(钢→不锈钢,在钢中加入镍和铬)
③电化学防护:用较活泼金属或外加电流的方法为保护的金属提供电子,以免被保护金属失去电子。如:
牺牲阳极阴极保护法(较活泼金属作 极,钢铁作 极被保护)
外加电流阴极保护法(外加电流,使钢铁被迫成为 极受保护)
[课堂复习]
(1)了解氧化还原反应本质是电子的转移。了解常见的氧化还原反应。
(2)了解化学反应中能量转化的原因,知道常见的能量转化形式。
(3)了解化学能与热能的相互转化。了解吸热反应、放热反应等概念。
(4)了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。
(5)了解原电池的工作原理,能写出电极反应和电池反应方程式。知道常见化学电源的种类。
(6)了解金属发生电化学腐蚀的原因、金属腐蚀的危害及其防止措施。
知识点1、了解氧化还原反应本质是电子的转移。了解常见的氧化还原反应。
例1、 图示四种基本类型反应与氧化还原反应的关系,并举例说明。
例2、下例说法不正确的是
A、某元素在化学反应中由化合态变为游离态,则该元素一定被氧化。
B、有单质参加的反应不一定是氧化还原反应。
C、氧化还原反应中肯定有一种元素被氧化,另一种元素被还原。
D、氧化还原反应的本质是化学反应中发生了电子得失。
知识2、了解化学反应中能量转化的原因,知道常见的能量转化形式。
例3、有关下列能量转化的认识正确的是
A、植物的光合作用使得太阳能转化成化学能
B、人类使用照明设备是将电能转化为光能
C、燃料燃烧时只是将化学能转化为热能
D、化学变化中物质发生能量变化的主要原因是化学键的断键和形成
知识点3、了解化学能与热能的相互转化。了解吸热反应、放热反应等概念。
例4、下列说法正确的是
A、需加热才能发生的反应一定是吸热反应。
B、吸热反应没有研究价值。
C、反应是吸热的还是放热的必须看反应物和生成物的总能量的相对大小。
D、伴有能量变化的物质变化都是化学变化。
例5、关于在一定温度和压强下,2molH2(g)和1molO2(g)完全化合生成2molH2O(g)所放出的热量有以下说法,你认为正确的是
A、与在相同条件下2molH2O(g)完全分解为2molH2(g)和1molO2(g)所吸收的热量在数值上相等
B、是相同条件下1molH2(g)和0.5molO2(g)完全化合生成1molH2O(g)所放出热量的2倍
C、比在相同条件下2molH2(g)和1molO2(g)完全化合生成2molH2O(l)所放出的热量少
D、与2molCH4(g)和适量O2(g)完全燃烧生成H2O(g)和CO2(g)所放出的热量相等
知识点4、了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。
例6、下列说法错误的是
A、发生光合作用时,反应物的总能量高于生成物的总能量。
B、反应2Fe+8H++2NO3-=2Fe3++2NO↑+4H2O既是吸热反应又是氧化还原反应。
C、用金属锌、铁、铜、石墨碳棒、导线、硫酸铜溶液可以构成多个原电池装置。
D、手机充电时,是电能转变成化学能。
例7、化石燃料(煤、石油、天然气)是不可再生的能源。下列说法正确的是
A、它们所含的主要元素有C、H,燃烧后生成的化合物主要是二氧化碳和水
B、高温下,煤与水蒸气反应生产水煤气是吸热反应
C、应大力开发新能源,目前可利用电解水的方法制取氢气作能源
D、化石燃料并非在任何情况下都能充分燃烧
知识点5、了解原电池的工作原理,能写出电极反应和电池反应方程式。知道常见化学电源的种类。
例8、下列关于原电池的说法正确的是
A、电流从原电池的负极流向正极
B、电子从发生氧化反应的电极流出
C、原电池是将化学能转变为电能的一种装置
D、原电池的两极,一定是由活动性不同的两种金属组成
例9、氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-,下列叙述正确的是
A.H2通入负极区 B.O2通入正极区
C.负极反应为2H2 + 4OH--4e- = 4H2O D.正极发生氧化反应
知识点6、了解金属发生电化学腐蚀的原因、金属腐蚀的危害及其防止措施。
例10、下列事实能用电化学理论解释的是
A、钢铁在潮湿的空气中容易生锈
B、轮船吃水线以下的船壳上装有一定数量的锌块
C、在空气中金属铝表面迅速被氧化形成保护膜
D、锌锰干电池工作一段时间后锌外壳逐渐变薄

例11、如右图所示,试管中的铁钉如果在酸性溶液中将发生析氢腐蚀,
正极材料: ,电极反应式为; ;
正极材料: ,电极反应式为; ;
电池总反应式为: 。
试管中的铁钉若在食盐溶液中的腐蚀呢?
[课后作业课后巩固]
多项选择题15题,每题3分,共30分,每题中至少有2个选项是正确的,全选对给3分,少选且正确给1分,错选给0分。
2、电化学腐蚀 (以钢铁为例)
(1)析氢腐蚀 (酸性较强的溶液)
负极:
正极:
总方程式:
(2) 吸氧腐蚀 (中性或碱性溶液)
负极:
正极:
总方程式:
Fe(OH)2继续与空气中的氧气作用:
注意:析氢腐蚀产生气体,而吸氧腐蚀消耗气体。
1、金属的腐蚀
①定义:金属或合金与周围接触到的气体或液体发生 反应而腐蚀损耗的过程叫金属的腐蚀。
②本质:金属原子失去电子变成金属阳离子的过程。
③分类:一般可分为 腐蚀和 腐蚀。
化学腐蚀:金属与接触到的物质(如O2、SO2、Cl2等)直接发生化学反应而引起的腐蚀。
温度越高,化学腐蚀越 。
电化学腐蚀:不纯的金属跟电解质溶液接触时,会发生 反应,较活泼的金属失去电子而被 。如 在潮湿的空气中生锈。
金属接触的介质不同,发生腐蚀的情况也不同,两种腐蚀往往 发生,但 腐蚀更普遍,速度更快,危害更严重。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com